R04 Tabel met elektronegatieve waarden
|
Doel: de elektronegatieve waarde van de elementen centraal stellen bij de beschrijving van redox-reacties in het algemeen en van de oxidatietrap in het bijzonder. |
In de hierboven
beschreven gevallen betrof het metalen en éénatomige metaalionen
waartussen zich een elektronentransfer voltrok. De volledige uitwisseling
van elektronen is hier evident.
Heel veel elektronentransferreacties betreffen echter ongeladen covalente
moleculen en/of meeratomige ionen. Bij de reactie die zich in een gasfornuis
voordoet, reageert methaan met dizuurstof, beide covalente moleculen.
Ook de reactieproducten CO2 en H2O behoren tot de
uitsluitend covalente stoffen. Dergelijke verbrandingsreactie komt fundamenteel
ook neer op een elektronentransfer tussen atomen.
Dit is duidelijk te bewijzen door beide bestanddelen traag te laten reageren in een galvanische cel, in dit geval een brandstofcel. Door deze cel wordt inderdaad elektriciteit (elektrische energie) geproduceerd uit chemische omzettingen (chemische energie).
![]()
Oxidatietrap
Om dergelijke reacties eveneens vlot als elektronentransferreacties te
kunnen beschrijven, moeten we boekhoudkundige regels volgen. Alleen dan
kunnen scheikundigen het eens geraken over de balansen van winst of verlies
aan elektronen tijdens een chemische omzetting.
De hoeksteen van deze elektronenboekhouding is de zogenaamde oxidatietrap
(O.T.) die aan een welbepaald atoom in een welbepaald deeltje (ion of
molecule) toegekend wordt :
De O.T. of het oxidatiegetal (O.G.) van een individueel atoom in een welbepaald deeltje is de elektrische lading in elektronenladingseenheden (e.l.e.) door dit atoom werkelijk gedragen, als ion in een ionenverbinding, of aan dit atoom toegeschreven door alle covalente bindingen als ionenbindingen voor te stellen.
Spelregel
: alle bindingselektronen in een covalente binding worden volledig verschoven
naar de meest elektronegatieve partner (zie R4). Bij gelijke elektronegatieve
partners worden de bindingselektronen gelijk verdeeld.
De hoeveelheid elektrische lading (niet in coulomb maar in elektronenladingseenheden)
die aan het atoom toegekend is, wordt dan gegeven door het groepsnummer
van het atoom verminderd met het aantal valentieelektronen dat op dit
atoom achterblijft.
Aangezien de 'oxidatietrap van een atoom' niet noodzakelijk neerkomt op
een echte ionlading, wordt deze O.T. aangeduid met :
een romeins cijfer (in plaats van een arabisch cijfer) voorafgegaan door + of – (in plaats van gevolgd door het ladingsteken)
Wie
derhalve wijst op de O.T. van een atoom (in een ion of in een neutrale
molecule), zal het dus hebben over bijvoorbeeld +II (plus twee) en niet
over 2+ (twee plus).
Het verschil tussen O.T. en ionlading is dus niet alleen leesbaar maar
ook hoorbaar !
Concreet :
ð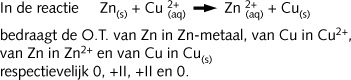
ð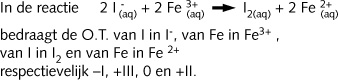
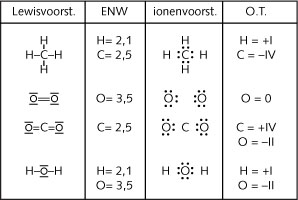
Noot :
om
de oxidatietrap van een covalent gebonden atoom ondubbelzinnig af te leiden,
moet men de verschuiving van de bindingselektronen (de spelregel) toepassen
op de Lewisvoorstelling van de molecule of het ion.
Voor I2 wordt de Lewisschrijfwijze![]() na toewijzing van de bindingselektronen en vindt men voor de O.T.(I) :
0, want het groepsnummer voor I bedraagt zeven en het aantal valentie-elektronen,
bij ionische voorstelling van de covalente binding, bedraagt ook zeven
:
na toewijzing van de bindingselektronen en vindt men voor de O.T.(I) :
0, want het groepsnummer voor I bedraagt zeven en het aantal valentie-elektronen,
bij ionische voorstelling van de covalente binding, bedraagt ook zeven
:
groepnummer 7 - 7 valentie-elektronen = 0.
ð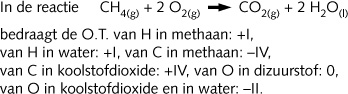
De afleiding van deze oxidatietrappen is hieronder geschematiseerd :
Na de invoering
van het begrip "oxidatietrap van een atoom", is het begrijpelijk
dat men veralgemenend de benaming "oxidoreductiereacties" of
"redox-reacties" is gaan gebruiken voor elektronentransferreacties.
Bijbehorende termen zijn : oxideren en reduceren, oxidator en reductor.
Als in een deeltje de O.T. van een atoom stijgt doordat (valentie-)elektronen
worden afgegeven, dan zegt men dat dit atoom geoxideerd wordt en dat het
deeltje in zijn geheel als reductor optreedt.
De afgegeven elektronen zullen door een (ander) atoom in een (ander) deeltje
opgenomen worden. Men zegt dan dat dit atoom gereduceerd wordt en dat
het deeltje in zijn geheel als oxidator optreedt.
Belangrijk :
Alle elektronen die door de reductor in een redox-reactie afgestaan
zijn, moeten ook door de oxidator opgenomen worden. Hiertoe moeten in
een redox-reactie de stechiometrische getallen van de oxidator
en de reductor ingevuld worden.
De symbolen Red en Ox staan respectievelijk voor ‘gereduceerde vorm’
en ‘geoxideerde vorm’.
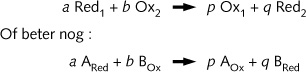
In deze reactievergelijking voor een redox-reactie kan men, in analogie
met zuur-basereacties, ARed of Red1 en AOx
of Ox1 de geconjugeerde oxidator-reductorparen noemen.
Hetzelfde geldt voor BOx of Ox2 en BRed
of Red2 .
Verderop, bij illustratie R5, zullen we zien dat deze principiële evenwichtsreactie, al dan niet zelfonderhoudend, hoofdzakelijk verloopt vanuit de richting van een relatief sterke reductor en een relatief sterke oxidator naar een zwakkere oxidator en een zwakkere reductor.
Bepaalde technieken die in de klas gehanteerd worden om de stechiometrische getallen voor een redox-reactie af te leiden, zijn vaak gebaseerd op de toepassing van de oxidatietrap-boekhouding. Nochtans biedt, ook voor de meeste redox-reacties, de gewone atoombalansmethode voldoende soelaas.
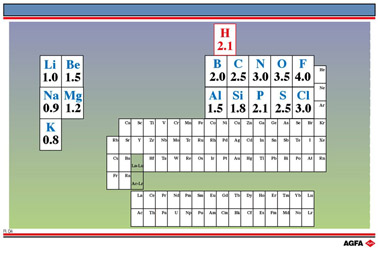
Elektronegatieve waarden
Op illustratie
R4 zijn de elektronegatieve waarden van de voornaamste elementen weergegeven.
In het licht van de redox-reacties, veel voorkomende en zeer toepasselijke
chemische omzettingen, is de oxidatietrapafleiding zeer belangrijk.
Een vlotte parate kennis van de elektronegatieve waarde (ENW) van bepaalde
elementen is dan ook even belangrijk als de kennis van hun elektronenconfiguratie
(aantal valentie-elektronen).
Het memoriseren ervan is trouwens zeer eenvoudig : voor Li geldt 1,0 als
ENW en tot F geldt een increment gelijk aan 0,5; van K tot Cl geldt een
increment gelijk aan 0,3 behalve voor de twee laatste elementen S en Cl.
In deze schaal bedraagt voor H de ENW 2,1. Waterstof is derhalve geen
metaal maar een niet-metaal !
De definitie die we voor de ENW van een element kunnen hanteren, is beslist
relevant voor de afleiding van de O.T. van een element :
de elektronegatieve waarde van een element is een maat voor de neiging
waarmee een element in een covalente binding de bindingselektronen naar
zich toe trekt.