R3 De klassieke galvanische cel
|
Doel : de klassieke galvanische cel schematiseren en vergelijken met vreemde maar analoge opstellingen. |
In de klassieke chemiecurricula maken de leerlingen kennis met de bekende
elektronentransferreactie tussen Zn-metaal enerzijds en Cu2+-ionen anderzijds.
Deze reactie kunnen we gemakkelijk rechtstreeks uitvoeren door onaangetast
zink (een stukje of korrels) in een waterige oplossing te gooien die Cu2+-ionen
bevat.
Meestal gebruikt men hiervoor het blauwe CuSO4.5H2O
of het wit-grijze CuSO4. In beide gevallen vertoont de waterige
oplossing een diepblauwe kleur. Vrij snel vermindert die kleurintensiteit
naarmate Cu2+-ionen op het Zn neerslaan in de vorm van een
bruine Cu-neerslag (een koperlaagje). Vanzelfsprekend is hier sprake van
een rechtstreekse uitwisseling van elektronen :
![]()
Uit de commentaar bij de illustraties R1 en R2 bleek reeds dat de elektronenuitwisseling
dan niet aanwijsbaar is. In plaats van elektrische energie levert zo’n
rechtstreekse reactie warmte op.
Wanneer we
met Zn en Cu2+ een opstelling realiseren die analoog is aan
die afgebeeld op illustratie R2 (rechts), dan creëren we weer een
bron voor elektrische stroom.
Om te komen tot de klassieke stroombron of galvanische cel, hier
de Daniell-cel genoemd, moeten we bij deze opstelling nog letten op een
paar bijzonderheden. Zo dienen we de omgevingstemperatuur op 25°C
te houden.
De platina-elektroden zijn vervangen door onaangetaste zink- en koperplaatjes.
De concentratie van de Zn2+-oplossing in contact met het zink
en de concentratie van de Cu2+-oplossing met het koper bedragen
allebei 1 mol/L. Welke anionen hierbij gebruikt worden, is in principe
willekeurig, maar de oplosbaarheid van de zouten moet voldoende groot
zijn.
Zo zouden o.a. nitraat-, chloride-, waterstofsulfaat- of sulfaatoplossingen
voor dit doel aangewend kunnen worden. In de praktijk valt de keuze meestal
op ![]()
oplossingen. Een interessante verantwoording hiervoor beschrijven we bij
transparant R7.
In de zoutbrug kunnen we kaliumnitraat of kaliumchloride, opgelost in
een agar-agar gel, gebruiken omdat het iongeleidingsvermogen van hun ionen
voldoende groot is en geen van de aanwezige ionen betrokken wordt in de
elektronentransferreactie uit ons voorbeeld.
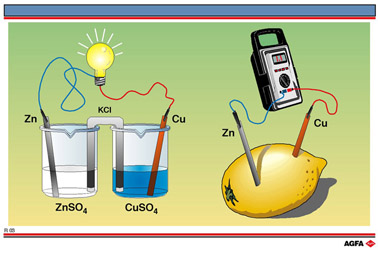
Op de illustratie
R3 links wordt gesuggereerd dat dergelijke galvanische cel in normomstandigheden
elektrische stroom zou leveren. Men kan er inderdaad eventueel een lampje
mee doen branden, dat werkt onder een spanning van ongeveer 1 V en bovendien
weinig stroom verbruikt.
In de Daniell-cel die werkt als een stroombron, lopen elektronen van Zn
naar Cu, door de geleidende draden en door de gloeidraad (zie ook illustratie
R11).
In het bekerglas met het Zn-staafje worden de elektronen gevormd uit de
reactie :
![]()
De Zn2+ -ionen komen de van de staaf los en bewegen zich in
het water. De elektronen komen niet in het water terecht maar verplaatsen
zich in de metaalgeleiders naar de Cu-staaf toe.
In het bekerglas met de Cu-staaf worden de elektronen van de Cu-staaf
verwijderd door de naderende
Cu2+ -ionen :
![]()
De twee reagentia
die in dit proces langzaam reageren zijn dus Zn en Cu2+ . Men
kan werkelijk waarnemen dat de Zn-staaf kleiner wordt ('oplost') en de
Cu-staaf in omvang en massa vermeerdert : de Cu2+-ionen slaan
erop neer. Dit verdwijnen van de Cu2+-ionen uit de oplossing
vertaalt zich ook in een waarneembare vermindering van de blauwe kleurintensiteit.
Terwijl in de ene oplossing [Zn2+] stijgt, neemt in de andere
oplossing [Cu2+] af. Dit zou kunnen leiden tot een oplossing
die een teveel aan positieve lading draagt en een andere die overmatig
veel negatieve ionen bevat.
Dergelijke
ongewenste tegenspanning wordt vermeden door de werking van de zoutbrug:
de positieve metaalionen verplaatsen zich hoofdzakelijk naar de koper(II)-
oplossing terwijl de anionen (bv. chloride-ionen) hoofdzakelijk in de
zinkoplossing terechtkomen.
Vanzelfsprekend mogen noch de kationen noch de anionen omzettingen ondergaan
wanneer zij, in de oplossing, in contact komen met andere bestanddelen.
Alleszins wordt door het gebruik
van de zoutbrug vermeden dat de koper(II)-ionen terecht zouden komen bij
de Zn-staaf. Hierop zouden ze immers rechtstreeks reageren (neerslaan)
en de zinkstaaf in een koperstaaf omzetten. Dit zou nefaste gevolgen hebben
voor de verdere stroomdoorgang en voor de celspanning.
Naarmate de galvanische cel stroom levert, zal, langzaam weliswaar, de
elektrische spanning dalen die men tussen de metaalstaafjes kan opmeten
(zie Nernst-vergelijking bij illustratie R8). De stroombron zal uiteindelijk
geen stroom meer kunnen leveren zodra hetzij alle Zn verbruikt is, hetzij
alle Cu2+-ionen uit de oplossing verdwenen zijn (neergeslagen).
In het kader van de lessen chemie
is het stroomleveringsproces zeer interessant. Maar ook de elektrische
spanning tussen de metaalstaven krijgt onze aandacht.
Om de opgebouwde spanning te kunnen bestuderen, dient men ervoor te zorgen
dat de galvanische cel praktisch geen stroom levert. De gloeidraad wordt
dan vervangen door een spanningsmeter (voltmeter). In feite gebruikt men
een voltmeter waarvan de spanning precies tegengesteld aan en precies
even groot als de eigenlijke celspanning is. Zo’n voltmeter wordt
een potentiometer genoemd. De celspanning wordt dan niet verminderd door
de spanningsval langs de draden, in de oplossingen, in de zoutbrug, enz.
De 'potentiometrisch' gemeten spanning van een Daniell-cel in normomstandigheden
van temperatuur (25°C) en concentraties ([Zn2+] en [Cu2+], beide 1
mol/L), bedraagt 1,1 V.
Links op illustratie R11 is een Daniell-cel getekend waarop o.a. de deeltjes aangeduid zijn die bij de eventuele stroomdoorgang betrokken zijn. Ook de richting waarin deze deeltjes zich dan hoofdzakelijk bewegen is erop aangeduid.
Merk ook
even op dat de zinkstaaf hier voorgesteld wordt met vele streepjes erop
die de elektronen voorstellen. Dat er ook op de koperstaaf elektronen
getekend zijn, weliswaar in mindere mate, kan u verwonderen. Dit strookt
evenwel met de aangeduide polariteit.
In de chemie is het gebruik van modellen schering en inslag. Modelmatig
is het dan ook zeer aannemelijk dat, als zink Zn2+-ionen in oplossing
brengt, koper eveneens Cu2+-ionen aan het water afgeeft, maar dit in veel
geringere mate dan zink (zie illustratie R5).
Het is dan ook normaal dat bij Zn een negatief teken wordt geschreven
en bij Cu een positief (want er bevinden zich veel minder elektronen op
de koperstaaf).
De zinkstaaf
samen met de oplossing van ZnSO4 vormen het anodecompartiment. De zinkstaaf
zelf wordt een elektrode genoemd, namelijk de ANODE.
De koperstaaf samen met de oplossing van CuSO4 is het kathodecompartiment.
De koperstaaf wordt de KATHODE genoemd.
Je zal merken dat we, zoals de internationale afspraak het vereist, de
anode steeds links voorstellen en de kathode rechts. Het zou onvoorzichtig
zijn te beweren dat de anode steeds als negatief wordt voorgesteld en
de kathode steeds als positief. Dit is alleen zo bij galvanische cellen.
Bij elektrolysecellen is het precies omgekeerd. Voor een algemene definitie
van anode en kathode verwijzen wij naar de duiding bij illustratie R11
. Daar moet blijken dat de anode, zowel bij elektrolysecellen als bij
galvanische cellen, steeds de elektrode is waar zich een oxidatie afspeelt;
aan de kathode treedt dan in beide gevallen een reductiereactie op.
Om de grote
variëteit aan galvanische cellen, waarin chemische energie rechtstreeks
in elektrische energie kan worden omgezet, op een eenvoudige manier te
kunnen beschrijven, hanteert men doorgaans internationale afspraken.
Zo geldt voor de Daniell-cel in normomstandigheden de volgende conventionele
notatie:
![]()
Ook hier wordt de anode links geschreven. De scheiding tussen de vaste fase en een oplossing wordt door een vertikale streep gesymboliseerd. Om een zoutbrug voor te stellen, gebruikt men een dubbele vertikale streep. Let erop dat bij ionen de concentratie moet weergeven worden; het subscript (aq) mag eveneens vermeld worden.
Rechts op illustratie R3 wordt
een citroen getoond waarin men twee voldoende grote plaatjes voldoende
diep gestoken heeft. Het plaatje links is van zink, het plaatje rechts
van koper.
Wanneer de beide strips met een voltmeter geleidend verbonden worden,
zullen we een spanning (weliswaar geringer dan 1,1 V) kunnen aflezen.
Ook in zo'n schijnbaar buitenissig geval fungeert de zinkelektrode als
anode en de koperelektrode als kathode. In de citroen bevinden zich blijkbaar
andere bestanddelen (ionen) die de rol van Zn2+ maar vooral
van Cu2+ kunnen overnemen, althans gedeeltelijk.
In het citroenweefsel is de diffusie van deeltjes (ionen) vertraagd zodat
de aanvankelijke spanning weliswaar vermindert maar toch nog een tijdje
aanhoudt, en dit niettegenstaande het feit dat beide elektrodes, hier
zonder zoutbrug, in eenzelfde oplossing gedompeld zijn.