R01 - R02 Reacties van het niet-redoxtype - Elektronentransferreacties
|
Doel : aantonen dat aan bepaalde chemische reacties elektrische aspecten verbonden zijn : het bestaan van elektronentransferreacties. |
Op het eerste gezicht beantwoordt aan de veelheid van chemische reacties
een grote fundamentele verscheidenheid. Men zou inderdaad, naargelang
van de criteria die men hanteert, chemische reacties kunnen indelen in
: synthesereacties, ontbindingsreacties, dissociatiereacties, complexatiereacties,
neerslagreacties, vervangingsreacties, zuur-basereacties, redox-reacties,
en zo meer.
Sommigen zullen geneigd zijn om bepaalde van deze reactietypes niet als
werkelijk chemische verschijnselen op te vatten, omdat zij niet gepaard
zouden gaan met een verandering in de elektronenstructuur van de (geladen)
atomen. Zo kan het uiteenvallen, bijvoorbeeld in water, van een ionenverbinding
in de ionen waaruit zij samengesteld is, eventueel beschreven worden als
een louter fysisch verschijnsel. Analoog voor het omgekeerde fenomeen
: de vorming van een kristallijne neerslag uit opgeloste ionen.
Veronderstel
echter dat wij ons ruim opstellen en ook de zojuist beschreven 'veranderingen'
tot de chemische reacties rekenen.
Komt
u nu even mee op ontdekkingstocht ?
Hiertoe voeren we enkele eenvoudige experimenten uit, te volgen op de
illustraties R1 en R2.
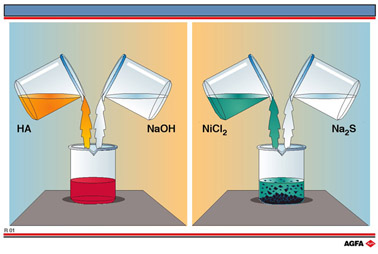
Links op illustratie R1 wordt een kleurige met een kleurloze waterige
oplossing gemengd. Een nieuwe kleur ontstaat die niet verklaard kan worden
op basis van een louter fysische vermenging (verdunning). We durven te
spreken van een chemisch verschijnsel. Maar van welk type is dergelijke
chemische reactie ?
Dit
is niet steeds in één twee drie uit te maken. Met meer concrete
gegevens geraken we toch al verder.
Illustratie R1 links suggereert een waterige oplossing van een (zwak)
zuur HA dat vermengd wordt met een waterige oplossing van NaOH, een éénwaardige
base.
Om de gele kleur te krijgen, hebben we het zwakke zuur fenolrood (waarvan
we hier slechts één dissociatie bekijken) in neutraal water
overgebracht. Van NaOH is voldoende bekend dat, zoals van vele alkaliverbindingen,
de waterige oplossing kleurloos is.
Dat het mengen van beide oplossingen niet resulteert in een gele oplossing,
lichter van kleur dan de
HA-oplossing, wijst erop dat hier meer aan de hand is dan eeneenvoudige
verdunning.
We kunnen genoegen nemen met de veronderstelling dat een gewone zuur-basereactie
:
![]()
optreedt waarbij het anion A- verantwoordelijk zou zijn voor de rode kleur. Dergelijke zuur-basereacties worden doorgaans ondergebracht onder de zogenaamde protonentransferreacties.
Het rechterdeel van illustratie R1 toont een analoge vermenging van een groene oplossing van nikkeldichloride in water met een kleurloze waterige oplossing van natriumsulfide.
Ook deze vermenging gaat gepaard met een kleurverandering die niet terug te brengen is tot een louter verdunningsfenomeen : in plaats van een lichtgroener mengsel ontstaat een zwarte kleur. Meer nog, het ontstane mengsel blijft niet homogeen. We spreken hier van een neerslagvorming die toe te schrijven is aan de geringe oplosbaarheid van NiS, een zout van het zeer zwakke zuur HS-.
Aangezien de concrete bestanddelen NiCl2 en Na2S uit ionen opgebouwd zijn, kunnen we ons voorstellen dat, naarmate deze bestanddelen oplossen in water, deze ionen van elkaar loskomen :
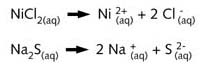
De vraag is dan of er zich, tussen de opgeloste deeltjes, geen nieuwe 'combinaties' van kationen met anionen kunnen voordoen. Zo verwachten we dit van Na+-ionen met Cl--ionen en van Ni2+-ionen met S2--ionen. De eerste combinatie komt neer op een verbinding die goed opgelost blijft (dan opnieuw in de vorm van ionen). De tweede combinatie vertegenwoordigt een weinig oplosbare verbinding : de samenstellende ionen blijven bijeen, rangschikken zich in een massief rooster en vormen aldus een neerslag :
![]()
Reacties met dergelijke karakteristieken vermeldt men meestal onder de reacties van neerslagvorming.
Bij een uitgebreidere vergelijking van reacties die zich kunnen voordoen
bij het mengen van zowel kleurige als kleurloze oplossingen, zal snel
opvallen dat beslist niet alle reacties aan één van de voorgaande
patronen beantwoorden.
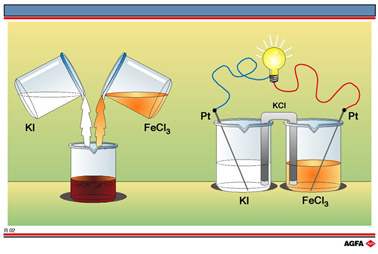
Illustratie R2 illustreert zo'n geval.
Links
wordt getoond hoe een kleurloze oplossing van KI in water samengegoten
wordt met een okerkleurige oplossing van FeCl3 in water. Het
eindresultaat is ook weer verrassend : niet een lichter gekleurde oplossing,
maar een anders gekleurde oplossing, nl. roodbruin.
Denkend aan de deeltjes die we in de oplossing verwachten, kunnen we moeilijk
de kleurwijziging verklaren in termen van een zuur-basepatroon. Nog minder
in termen van een reactie van neerslagvorming.
De ionen die, in water, uit de opgeloste ionenverbindingen
vrijkomen, zijn :
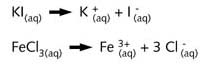
Tenzij bij vrij hoge concentraties van deze ionen, zullen noch de combinatie van K+ met Cl- , noch de combinatie van Fe3+ met 3 I- een neerslag opleveren. Beide zouten zijn vrij goed oplosbaar.
We nemen dus aan dat er bij het mengen, in water, van KI met FeCl3 geen sprake is van protonentransfer noch van neerslagvorming. Welk ander chemisch fenomeen doet er zich dan wel voor ?
Het antwoord op deze vraag krijgen we door dezelfde bestanddelen in een andere opstelling met elkaar te laten reageren, zoals u kunt zien op de rechterkant van illustratie R2. De beide oplossingen worden hier niet (rechtstreeks) gemengd. Ze zijn wel verbonden via een zogenaamde zoutbrug, een U-vormig buisje opgevuld met een gel waarin veel KCl aanwezig is. In ieder van de oplossingen is een (inerte) geleidende platinastaaf gedompeld die telkens elektrisch verbonden is met een lampje, een ampèremeter of een voltmeter.
Het
verrassende van deze opstelling is nu wel dat zij een lampje kan doen
branden of op een ampèremeter enige stroomdoorgang aanduidt. De
chemische bestanddelen brengen in deze opstelling een elektrische stroom
voort.
We kunnen hier spreken van elektronentransfer tussen de reagerende chemische
stoffen. Men classificeert dergelijke reacties dan ook als elektronentransfer-reacties.
Opgelet !
Het is gemakkelijker om een uitwijking te zien op
een ampèremeter dan om het lampje te doen branden. Men kan de transfer
van ladingshoeveelheid echter vermeerderen door elektroden te gebruiken
met bv. Grotere contactoppervlaktes. Het lampje kan ten hoogste een fietslichtlampje
zijn dat werkt onder geringe spanning en vooral met weinig stroomintensiteit.
Zulke
verrassende elektriciteitsaspecten kunnen we niet aantonen indien
dezelfde oplossingen rechtstreeks met elkaar reageren (links), ook al
plaatsen we de elektroden enz. in het onderste bekerglas.
Dit betekent echter niet dat de elektronentransfer zich niet zou voordoen
bij een rechtstreekse reactie van de KI-oplossing met de FeCl3-oplossing.
De elektronen worden niet op de elektroden afgezet, maar van stof (ion)
tot stof (ion) overgedragen, volgens het schema
![]()
De samenstellende halfreacties (zie verder) schrijven we, de index (aq) weglatend :
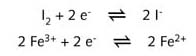
Alle
elektronen die door de I--ionen zijn afgestaan, worden door
de Fe3+ -ionen opgenomen.
In de linkeropstelling, de rechtstreekse elektronentransferreactie, komen
er geen elektronen in het water terecht. Zij worden rechtstreeks van deeltje
(ion of molecule) tot deeltje (molecule of ion) uitgewisseld.
In geval van een opstelling zoals die rechts op transparant R2, worden
de elektronen, langzamer dan in het eerste geval, van I- naar
Fe3+ overgebracht via de geleidende draden, doorheen de gloeilampdraad.
Doorheen de zoutbrug en in de oplossingen zelf gebeurt het ladingstransport
door andere ladingsdragers: ionen (zowel kationen als anionen).
Meer hierover bij transparant R3.
Bovendien zorgt de zoutbrug ervoor dat de twee oplossingen niet in elkaar diffunderen.
Deze korte
zoektocht leert ons dat er wel d egelijk zulke speciale en bijzonder interessante
chemische reacties bestaan.
Mocht u dan weer denken dat alle chemische reacties tot dit ene type terug
te brengen zijn, dan zijn controleproeven op andere reacties, zoals die
op transparant R1 vermeld, uiterst noodzakelijk.
In opstellingen analoog met die op transparant R2 (rechts), kan men voor
protonentransferreacties (links op R1) of voor neerslagreacties (rechts
op R1) geen stroomdoorgang registreren.