R05 Rangschikking van halfreacties voor metalen - Tabel met enkele normreductiepotentialen
|
Doel : enkele metaal-redoxkoppels rangschikken volgens hun reducerend vermogen. |
In illustratie R3 hebben we kennis gemaakt met de onrechtstreekse, trage redox-reactie van zinkmetaal met koper(II)-ionen in waterige oplossing :
![]()
Deze elektronentransferreactie
kunnen we ook rechtstreeks en sneller realiseren door bijvoorbeeld een
proper zinkstaafje te dompelen in een oplossing van een goed oplosbaar
koper(II)-zout. Het anion van Cu2+ is hier nauwelijks van belang
aangezien weinig species aanwezig zijn waarmee het zou kunnen reageren.
We kunnen bijvoorbeeld het goed oplosbare
Cu(NO3)2gebruiken.
Deze concrete redox-reactie is een zelfonderhoudende omzetting. In thermodynamische termen heet het dat DG nogal negatief uitvalt. Kinetisch stelt deze reactie ook geen problemen: zij hoeft zelfs niet in gang gezet te worden.
Welnu, indien
we werkelijk te doen hebben met een (zelfonderhoudende) redox-reactie,
dan is er een reductor én een oxidator bij betrokken.
Eenvoudige waarneming heeft ons geleerd dat er tijdens deze reactie kopermetaal
uit Cu2+-ionen ontstaat. Het element Cu wordt dus geoxideerd
en Cu2+ is derhalve de oxidator. Dan moet Zn(s)
de rol van reductor spelen.
Noot :
Zelfs indien
we nog niet weten welke de reactieproducten zijn, kunnen we meestal toch
beredeneren welk reagens de reductor is en welk de oxidator.
Het reductor-reagens moet een element bevatten waarvan de oxidatietrap
kan stijgen. Dit kan hier niet Cu2+ zijn maar wel Zn(s) . Het oxidator-reagens
moet een element bevatten waarvan de oxidatietrap kan dalen; dit kan hier
niet Zn(s) zijn maar wel Cu2+.
Welnu, om
als reductor te kunnen optreden, moet Zn(s) vanzelfsprekend de meest gereduceerde
vorm zijn van een redox-koppel waarin het element Zn betrokken is.
Bovendien is het noodzakelijk dat deze meest gereduceerde vorm (Zn(s))
deel uitmaakt van een redox-koppel dat een groter reducerend vermogen
heeft dan het koppel waartoe het andere reagens behoort. En vice versa
voor de oxidator Cu2+.
Een reductor
is derhalve niet zomaar een bestanddeel (ion of molecule) waarin een element
meer gereduceerd is. Het bestanddeel moet ook behoren tot een redoxkoppel
met een groter reducerend vermogen, d.i. met een grotere neiging om elektronen
af te geven.
Een oxidator is niet zomaar een bestanddeel waarin een element meer geoxideerd
is. Dit bestanddeel moet ook behoren tot een redox-koppel met groter oxiderend
vermogen, d.i. met een grotere neiging om elektronen op te nemen.
Hieronder vindt u de redox-koppels of halfreacties die van toepassing
zijn bij de redox-reactie in kwestie :

Merk op
dat we de redox-koppels of redox-stelsels schrijven volgens de door IUPAC
aanbevolen Stockholmconventie, namelijk als reductie-halfreacties.
Bovendien is het dan ook gebruikelijk om, in navolging van de IUPAC-tabellen,
het redox-koppel met het grootste reducerend vermogen bovenaan te schrijven.
Zo kunnen
we stellen dat in dergelijke tabel de reductor uit een redox-reactie RECHTSBOVEN
staat terwijl de oxidator LINKSONDER staat.
Anders geformuleerd : indien tussen twee reagentia een redox-reactie optreedt,
dan weten we dat het ene reagens rechtsboven en het andere linksonder
gesitueerd is in de tabel van de halfreacties. De tabel moet dan wel opgesteld
zijn op de conventionele manier, d.w.z. halfreacties worden voorgesteld
als reductie-reacties, waarbij die met het grootste reducerend vermogen
bovenaan staan.
Elektrochemische potentialen voor halfreacties.
Dat van beide redox-koppels het
![]()
het meest
reducerende is, betekent dat de neiging van
Zn(s) om elektronen af te staan en hierbij ![]() te vormen, groter is dan de neiging van Cu(s) om elektronen
af te geven onder vorming van
te vormen, groter is dan de neiging van Cu(s) om elektronen
af te geven onder vorming van ![]() .
.
De neiging van een redox-koppel om elektronen af te staan is moeilijk
meetbaar, althans niet rechtstreeks.
Dit reducerend vermogen is wel vergelijkbaar met de analoge neiging bij
een referentiestelsel.
Volgens
de IUPAC-afspraak wordt het de halfreactie
![]()
als referentiekoppel
genomen. Zonder de redenen hiervoor aan te halen, stellen we kortweg dat
het reducerend vermogen van dit referentiekoppel uitgedrukt wordt in volt
(V). Eveneens bij conventie, niet per definitie, werd aan het reducerend
vermogen van dit stelsel de waarde 0 V toegekend.
Aangezien de temperatuur en de concentraties van de betrokken bestanddelen
dit reducerend vermogen beheersen (zie verder), moeten we dit reducerend
vermogen precieser uitdrukken:
Aan dit referentiestelsel
werd, bij 25 °C, een concentratie van ![]() gelijk aan 1 mol/L en een partiële druk van H2(g) gelijk
aan 1 013 hPa de waarde van 0 V toegekend als maat voor zijn reducerend
vermogen.
gelijk aan 1 mol/L en een partiële druk van H2(g) gelijk
aan 1 013 hPa de waarde van 0 V toegekend als maat voor zijn reducerend
vermogen.
Men zegt ook dat de norm(reductie)potentiaal voor de halfcel 2 H+/H2
precies 0 V bedraagt.
Noot :
Voor de term
'normpotentiaal' gebruikt men in de elektrochemie allerlei alternatieven
of synoniemen :
norm- of standaardpotentiaal, norm- of standaardreductiepotentiaal,
norm- of standaardelektrodepotentialen,
norm- of standaardredoxpotentialen enz.
Voor zover dat de term 'normpotentiaal' voor sommigen zowel een oxidatiepotentiaal als een reductiepotentiaal kan betekenen, is het gebruik van de meest éénduidige term 'normreductiepotentiaal' verdedigbaar.
De waarde
van een normreductiepotentiaal (in V) heeft in zekere mate iets te maken
met de waarde voor de evenwichtsconstante K van het betrokken reductieevenwicht.
Dit dient echter niet geïnterpreteerd te worden als een absolute
maat voor de ligging van een reductie-evenwicht maar wel als een relatieve
maat.
Indien, zoals uit metingen en/of tabellen blijkt, bij het reductie-evenwicht
![]() in
norm- of standaardomstandigheden de waarde -0,76 V hoort, dan kunnen we
hieruit alleen besluiten dat, in dezelfde normomstandigheden gemeten,
het reductie-evenwicht bij
in
norm- of standaardomstandigheden de waarde -0,76 V hoort, dan kunnen we
hieruit alleen besluiten dat, in dezelfde normomstandigheden gemeten,
het reductie-evenwicht bij ![]() /Zn(s)
meer naar links gelegen is dan bij
/Zn(s)
meer naar links gelegen is dan bij ![]()
Een redox-koppel
met een grote negatieve waarde voor zijn normreductiepotentiaal betekent
dus een relatief groot reducerend vermogen voor deze halfreactie.
Zulke koppels (uit een halfreactie) staan in de gebruikelijke tabel bovenaan.
Een halfcel met een grote positieve waarde voor zijn normreductiepotentiaal
duidt op een relatief groot oxiderend vermogen. Zulke stelsels staan eerder
in het onderste gedeelte van de tabel.
Rangschikking van normreductiepotentialen
We bekijken hier eerst hoe men zo'n relatieve rangschikking kan samenstellen en daarna hoe men van zo'n rangschikking of tabel nuttig gebruik kan maken.
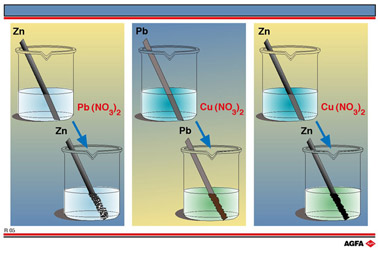
Illustratie
R5 schematiseert drie experimenten die telkens betrekking hebben op een
rechtstreekse redoxreactie.
Helemaal rechts herkennen wij de opstelling waarin zinkmetaal (Zn(s))
gedompeld wordt, we veronderstellen bij kamertemperatuur, in een waterige
oplossing van Cu2+-ionen bij een concentratie van ongeveer
1 mol/L.
Om deze concentratie ook in de twee overige experimenten te kunnen realiseren,
nemen wij onze toevlucht tot nitraten i.p.v. de gebruikelijke sulfaten.
Over het resultaat van het contact tussen het Zn-metaal en de blauwe oplossing
van Cu(NO3)2 zijn we geenszins verwonderd : het
zinkplaatje wordt aangetast en het wordt bedekt met een donkerbruine neerslag
van Cu(s).
De oorspronkelijk blauwe oplossing wordt minder blauw.
Na enige tijd neemt de kleurintensiteit minder snel af: de aantasting
van het staafje is bemoeilijkt door de koperneerslag.
Zoals hierboven verduidelijkt, volstaat dit experiment om te bevestigen dat in een tabel van normreductiepotentialen, gerangschikt van meer reducerende naar meer oxiderende halfreacties, déze concrete redoxkoppels als volgt geordend moeten zijn

Indien Zn(s) niet rechtsboven zou staan en Cu2+ niet linksonder, dan zouden deze redox-reacties tussen beide niet mogelijk zijn.
In een analoge opstelling (midden op illustratie R5) wordt door de redox-reactie tussen een loodplaatje met een waterige oplossing van een Cu2+-zout bewezen dat de betrokken ion-metaalstelsels onderling als volgt geordend moeten zijn :

Aangezien
loodmetaal zich als reductor gedraagt ten opzichte van Cu2+-ionen
en deze laaste als oxidator, is het absoluut vereist dat Pb(s),
voor het element Pb, de meest gereduceerde vorm is van een meer reducerend
stelsel en dat ![]() het bestanddeel is waarin het element Cu het meest geoxideerd is in een
halfreactie met een groter oxiderend vermogen.
het bestanddeel is waarin het element Cu het meest geoxideerd is in een
halfreactie met een groter oxiderend vermogen.
Om uit te
maken waar het stelsel ![]() zich
zich
bevindt ten opzichte van de voorgaande kan men best, zoals in de experimentele
opstelling links op illustratie R5, zinkmetaal rechtstreeks in contact
brengen met een oplossing van Pb2+-ionen, ongeveer 1 mol/L.
Ook hier doet zich inderdaad een redox-reactie voor : de vorming van een
mooie 'loodboom', d.i. een afzetting van fijn glinsterend loodmetaal op
het zinkstaafje.
Dit experiment bewijst voldoende dat het koppel
![]() /Zn(s)
een groter reducerend vermogen heeft dan het stelsel
/Zn(s)
een groter reducerend vermogen heeft dan het stelsel ![]() .
.
In de conventioneel weergegeven tabel van normreductiepotentialen moet
het stelsel
boven de twee andere bevinden :

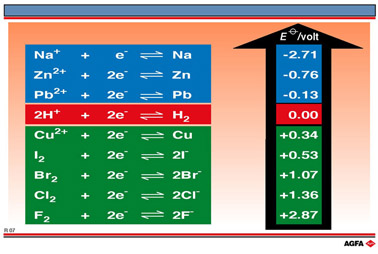
In illustratie
R7 is de rangschikking van de normreductiepotentialen weergegeven zoals
die overeenstemt met deze drie experimenten.
De aangeduide waarden voor de normreductiepotentialen, steeds t.o.v. het
referentiestelsel, kunnen nagegaan worden door potentiometrisch de spanning
op te meten van een galvanische cel waarin het stelsel ![]() ,
samen met een platinaplaatje, één van de elektrodes is (de
waterstofgas-elektrode).
,
samen met een platinaplaatje, één van de elektrodes is (de
waterstofgas-elektrode).
Noot :
Indien experimenten
zoals die afgebeeld op illustratie R5 geen redox-reactie aantonen, mag
men eigenlijk niets besluiten aangaande de rangschikking van de koppels.
Er kunnen verschillende redenen zijn waarom een reactie zich niet voltrekt
of geen waarneembare veranderingen laat zien. Misschien neemt iemand niet
goed waar, heeft men te weinig geduld of deed de experimentator iets verkeerd.
Vaak betreft het een kinetisch probleem : er is dan een aanzet of aansteking
nodig (katalysator).
Dezelfde voorzichtigheid is geboden indien men bijvoorbeeld geen reactie
waarneemt tussen een loodplaatje en een oplossing van Zn2+-ionen.
Dit negatieve resultaat bewijst nog niet noodzakelijk dat de reactie van
Zn(s) met Pb2+-ionen wel waarneembaar zal zijn of
dat Zn(s) en Pb2+-ionen respectievelijk reductor
en oxidator moeten zijn.