C03 Het gedrag van colloïdale oplossingen - thixotropie
|
Doel : Aangeven welke fenomenen optreden wanneer de interactiekrachten tussen colloïdale deeltjes uit balans geraken. |
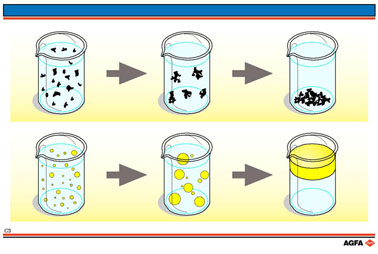
Wanneer de deeltjes in een colloïdaal systeem elkaar naderen en botsen, bepaalt de balans van aantrekkings- en afstotingskrachten de stabiliteit van het systeem. In geval de Van der Waals - aantrekkingskrachten groter zijn dan de Coulombafstotingskrachten en/of de sterische repulsie, zullen de deeltjes van het colloïdaal systeem “samenbinden” of “aggregeren”.
In geval
de deeltjes vaste stof zijn in een vloeibare continue fase (suspensie),
zal dit “samenbinden” aanleiding geven tot de vorming van
“vlokken”.
Dit zijn driedimensionele structuren van aggregerende deeltjes. Indien
het soortelijk gewicht van deze deeltjes groter is dan dat van de continue
fase, zullen de vlokken uitzakken of sedimenteren.
Het
sediment dat wordt gevormd, is weinig compact en kan gemakkelijk opnieuw
worden opgeroerd, zonder dat echter de situatie van de stabiele dispersie
ooit terug wordt bereikt.
In geval de deeltjes vloeistof zijn in een vloeibare continue fase (emulsie)
, zal dit “samenbinden” aanleiding geven tot een vervloeien
van de grensvlakken tussen beide fasen en ontstaat een macroscopisch twee-fasen-systeem
(coalescentie).
Indien het soortelijk gewicht van de disperse fase kleiner is dan dat
van de continue fase, zullen de coalescerende druppels opstijgen of “opromen”.
Een “designer” van colloïdaal stabiele systemen zal er dus meestal voor zorgen dat deeltjes bij botsing niet “samenbinden” tot de fasescheiding erop volgt. Dit doet hij door ionen of moleculen toe te voegen die de elektrostatische of sterische repulsie versterken ten opzichte van de aanwezige aantrekkingskrachten.
In vele gevallen echter zoekt de chemicus naar stabiele emulsies of suspensies door het vormen van driedimensionale netwerken van vlokkende deeltjes. Zo wordt de viscositeit van de continue fase dermate verhoogd dat het sedimenteren of opromen immens wordt vertraagd.
Een
voorbeeld :
Melk is een emulsie van vetdruppeltjes in water.
Door het toevoegen van zuur verandert men de lading die deze vetdruppeltjes
op hun oppervlak dragen. Het mechanisme van ladingsstabilisatie gaat door
de knieën en er treedt uitvlokking op van deze vetdruppeltjes. Wie
thee drinkt met melk én citroen kan dit tot zijn eigen ongemak
vaststellen.
Onze voorouders
bereidden boter door de melk te “stampen” in een botervat
: wanneer de toegevoegde mechanische energie die leidt tot een hogere
frequentie van botsingen tussen de vetdruppeltjes, groter is dan de stabilisatie
door de Coulomb-afstotingskrachten en de sterische repulsie tussen de
druppeltjes, treedt coalescentie op en kitten de vetdruppels aaneen tot
boter.