C02 Deeltjesgrootteverdelingen en vlokking
|
Doel : Aangeven welke interactiekrachten in een colloïdale oplossing werken. |
Doordat
de deeltjes in een colloïdaal systeem geringe afmetingen hebben,
zijn zij voortdurend in beweging . Zij naderen elkaar en botsen onophoudelijk.
Hun groot specifiek oppervlak zorgt ervoor dat het aantal botsingen zeer
groot is en dat de deeltjes een hoge reactiviteit bezitten.
Wanneer
twee deeltjes elkaar tot op korte afstand zijn genaderd, kunnen de volgende
krachten optreden :
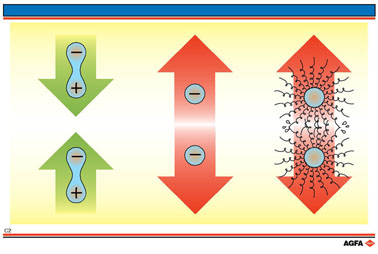
- de Van der Waals - aantrekkingskracht die bepaald wordt door de aanwezigheid
van dipolen (geïnduceerd of niet) in de deeltjes.
- de Coulomb - afstotingskrachten als gevolg van het feit dat de deeltjes een gelijknamige lading dragen, bijvoorbeeld door adsorptie van ionen uit de continue fase. Gelijknamige ladingen stoten elkaar af.
- de sterische repulsie treedt op wanneer grote moleculen (polymeren, al dan niet elektrisch geladen) adsorberen op het oppervlak van de deeltjes. De “harige mantel” die op deze wijze ontstaat, zorgt ervoor dat de deeltjes elkaar niet zó dicht kunnen naderen dat de Van der Waals - aantrekkingskracht hen “samenbindt” .
De stabiliteit van een colloïdaal systeem hangt af van het evenwicht tussen deze drie soorten krachten. Indien de aantrekkingskrachten belangrijker zijn dan de repulsiekrachten, worden de deeltjes bij botsing “samengebonden”. Zijn de afstotingskrachten belangrijker, dan geeft de botsing aanleiding tot een “biljart-effect” (denk daarbij aan de balletjes in de lotto-trommel of in het snooker-spel).