C01 De drie krachten in de colloïdchemie
|
Doel : Aangeven welke de belangrijkste karakteristieken van een colloïdaal systeem zijn. |
De wereld van de colloïden bevindt zich tussen die van de moleculaire oplossing en die van de macroscopisch waarneembare systemen. De deeltjes in een colloïdaal systeem hebben gewoonlijk afmetingen tussen één en duizend nanometer. Hieruit vloeien een aantal belangrijke karakteristieken van colloïdale systemen voort :
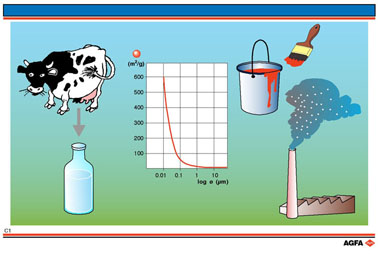
- Door hun geringe afmetingen bezitten de colloïdale deeltjes een groot specifiek oppervlak (= het oppervlak in verhouding tot het volume). Men kan zich voorstellen dat 1 gram van een poeder een steeds groter oppervlak zal bezitten naarmate de poederdeeltjes steeds kleiner worden. Reactiviteit en interactiemogelijkheid nemen toe met een stijgend specifiek oppervlak. Probeer maar eens een boomstam in brand te steken. Indien je de boom eerst tot spaanders zou hakken, zou hij een stuk gemakkelijker tot ontbranding komen.
- Door hun geringe afmetingen zullen zij ook op een aparte wijze op het licht inwerken. Dat de wolken wit zijn, dat sigaretterook blauwig is vóór het inhaleren en wit bij het uitblazen ervan, zijn voorbeelden van de lichtstrooiing die colloïdale deeltjes kunnen veroorzaken.
- De wereld rondom ons toont vele voorbeelden van colloïdale systemen. Zij worden ingedeeld op basis van de aggregatietoestand van de eigen disperse fase en die van de continue fase waarin zij zich bewegen :
- Suspensie : vaste stof in een vloeistof. Vb. verf, slijk.
- Emulsie : vloeistof in vloeistof. Vb. melk, mayonaise.
- Aërosol : vloeistof of vaste stof in gas. Vb. rook, spray.
-
Dispersie : verzamelnaam voor suspensie, emulsie, aërosol.