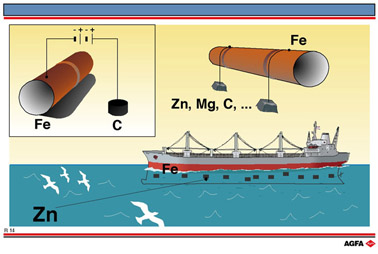
R14 Bestrijding van corrosie : verteringsblokken
|
Doel : aantonen dat door het gebruik van relatief kleine 'verteringsblokken' of door het aanleggen van een relatief grote spanning, grote metaalopppervlakken beschermd kunnen worden tegen atmosferische corrosie. |
Bij gebruik van verteringsblokken wordt doelbewuste aantasting
van déze materialen beoogd om zó te beletten dat het te
beschermen materiaal zelf corrodeert.
Voorbeelden van zulke kathodische bescherming tegen corrosie
zijn op illustratie R14 afgebeeld. Om de voorstellingen op dit illustratie
goed te kunnen volgen, is het nodig om de gegevens voor ogen te houden
die reeds samengevat zijn in de tabel van de normreductiepotentialen bij
illustratie R13.
Verteringsblokken of opofferanodes bestaan uit een metaal zoals Mg, Al
en Zn behorend tot een halfreactie met een groter reducerend vermogen
dan het redoxkoppel Fe2+/Fe.
ð Illustratie R14 toont onderaan hoe op de stalen romp
van een zeeschip, zoals ook op de poten van
booreilanden, blokken zink worden gelast. Zn heeft,
meer nog dan Fe, de neiging om als reductor op te
treden t.o.v. O2 opgelost in water (zie tabel bij
tekst
van illustratie R13).
Een belangrijk nadeel van deze methode is dat het
verteringsblok zeer snel corrodeert en dus regelmatig
vervangen moet worden. De sterk vervuilende
corrosieproducten (Zn2+-ionen) die hierbij ontstaan,
zijn een bijkomend minpunt.
ð
Bovenaan rechts op illustratie R14 wordt getoond
hoe de buizen van een pijpleiding op regelmatige
afstanden elektrisch verbonden worden met
metaalblokken uit Mg, Al, Zn of eventueel grafiet.
Dergelijke opofferanodes die met de ijzeren pijp mee
in de grond gestopt worden, beschermen deze tegen
corrosie.
De nadelen van deze werkwijze zijn analoog aan die
welke optreden bij de bescherming van
scheepsrompen tegen maritieme corrosie.
ð Bescherming van kathodisch materiaal, in de strikte
zin van het woord, vinden we terug in maatregelen
waarbij de elektrische potentiaal zelf van de kathode
op een meer negatieve waarde wordt gebracht.
Bij illustratie R3 en vooral bij illustratie R11 is
beschreven dat de kathode van een galvanische cel
als positief aangeduid wordt en de anode als
negatief.
Toch komen ook op de kathode elektronen voor,
maar in mindere mate dan op de anode. Welnu, door
via een externe stroombron de kathode met
elektronen te voeden zal de oxidatie er moeilijker
verlopen. Een daling van de elektrische potentiaal
met 100 mV vermindert de oxidatiesnelheid met een
factor 5 tot 100.
Op een vrij analoge wijze kan ook een kathodische
stroom aan het metaal aangelegd worden. In de
praktijk wordt het te beschermen metaal omringd
door goed geleidende maar inerte blokken (bv. In
grafiet) en zorgt een spannings- of een stroombron
voor het gewenste effect.
De voordelen van deze methode t.o.v. de methode met verteringsblokken
zijn : een beter meetbare en beter controleerbare bescherming, een geringere
nood aan opoffermateriaal en minder corrosieproducten die in het milieu
terechtkomen.
Deze beschermingstechniek treffen we voornamelijk aan in de petrochemie
(leidingen en opslagtanks), in betonconstructies (bescherming van betonijzer)
en in de maritieme wereld (schepen, haveninstallaties en boorplatforms).
Deze bescherming tegen corrosie is bijzonder betrouwbaar maar ook duur.