R15 Een loodaccumulator
|
Doel : de samenstelling, de werking en de kenmerken van een loodaccumulator beschrijven. |
Een accumulator,
kortweg een accu genoemd, of meer algemeen een batterij, is een schoolvoorbeeld
van een toepassing uit de elektrochemie. Fundamenteel is een accu een
galvanische cel : chemische bestanddelen die als anode fungeren en andere
die de rol van kathode vervullen. Verder is er nog een elektrolytoplossing
of een elektrolytpasta nodig en een poreuse scheiding of zoutbrug tussen
het anode- en het kathodecompartiment.
Zo’n
galvanische cel is een toestel (zie illustraties R3 en R11) waarin chemische
energie opgestapeld is. Door tussen de anode en de kathode van zo'n cel
een elektrische weerstand te schakelen (een motor, een lamp, enz.) zal,
volgens een zelfonderhoudende elektronentransferreactie, chemische energie
in elektrische energie omgezet worden (zie ook illustratie R13). Een accu
is dus in wezen een chemische stroombron.
In onze moderne
samenleving staat het belang van chemische stroombronnen of van accu’s
buiten kijf.
Hun afmetingen variëren van een minuscule knopcel (zoals in een disc-man)
tot een tonnenzwaar blok dat als 'noodstroombron' fungeert waarmee elektriciteit
kan geleverd worden voor hospitalen, vaar- en voertuigen.
Accu’s worden bijna steeds vervaardigd met het oog op een zeer specifieke
toepassing. Zo geniet de loodaccu zeer ruime bekendheid als elektrochemische
stroombron in auto's, van klein tot groot.
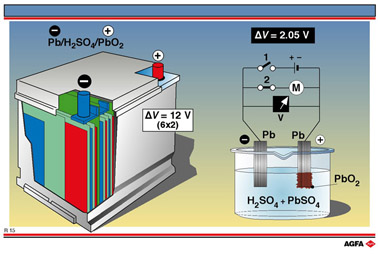
Op illustratie R15 is zo'n loodaccu afgebeeld. In een polypropyleencontainer bevinden zich zes galvanische cellen (eenheidscellen) van ieder ongeveer 2 V (2,05 V) die in serie geschakeld zijn. Terwijl de spanning van een loodaccu onveranderlijk een veelvoud is van 2 V, kan het vermogen toch sterk variëren. Het vermogen kan men namelijk vermeerderen door iedere eenheidscel nog eens onder te verdelen in deelcellen die gescheiden zijn door microporeuse polyethyleenwanden. Alle anode- en kathodeplaatjes binnen een eenheidscel worden verbonden. De anode (kathode) van een eenheidscel ordt dan verder verbonden met de anode (kathode) van de volgende cel.
Iedere anode
van een loodaccu bestaat uit loodmetaal (Pb(s)). Iedere kathode
bestaat uit vast lood(IV)oxide of looddioxide dat gefixeerd is op een
onderlaag in lood, het materiaal waaruit beide polen van de accu bestaan.
De elektrolytoplossing bevat hier H2SO4. In een
galvanische cel met de halfreacties :
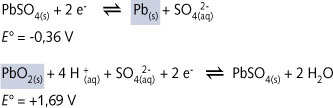
ð is
Pb(s) inderdaad het anodebestanddeel : loodmetaal
behoort
tot de meer reducerende halfreactie (van
beide)
en is het bestanddeel waarin het element Pb
een
lagere O.T. heeft dan dit het geval is voor
hetzelfde
element in PbSO4(s), de stof die links staat
in
de halfreactie.
ð is
PbO2(s) het kathodebestanddeel : lood(IV)oxide
behoort
tot het meer oxiderende systeem (van beide) en
is een bestanddeel waarin het element Pb een
hogere
O.T. vertoont dan Pb in het geval van
PbSO4(s).
Indien de schrijfwijze en de ordening inderdaad beantwoorden aan de IUPAC-afspraken hieromtrent, dan staat de reductor Pb(s) rechtsboven en de oxidator PbO2(s) linksonder. Deze chemische bestanddelen zijn dus respectievelijk de anode en de kathode van de loodaccu.
Indien de
[![]() ]
aan beide elektrodes 1 mol/L bedraagt, bereikt de elektrochemische spanning
tussen beide elektroden DV of
DE :
]
aan beide elektrodes 1 mol/L bedraagt, bereikt de elektrochemische spanning
tussen beide elektroden DV of
DE :

Deze celspanning
van 2,05 V stemt overeen met een belangrijke negatieve waarde van DG°.
De redox-omzetting :
![]()
gaat gepaard met een beduidende afname van de Gibbs-vrije energie. De
neiging om te reageren is dus zeer groot. M.a.w. de reactie naar rechts
zal een zelfonderhoudende reactie zijn. Uit de praktijk weten we dat zij
bovendien spontaan verloopt, zonder dat zij in gang dient te worden gezet.
Er manifesteren zich blijkbaar geen onoverkomelijke kinetische problemen
voor deze reactie.
Door
de contactsleutel van een wagen om te draaien, sluit men een stroomkring
waarin de accu elektrische stroom kan leveren.
De redox-reactie die bij deze ontlading plaatsvindt, verbruikt het materiaal
zowel van de anode als van de kathode, maar ook van H2SO4!
De loodaccu in de meeste personenwagens heeft een spanning van ongeveer
12 V : zes van de beschreven 2,05 batterijen zijn er in serie geschakeld
: zie illustratie R15 links.
Ondanks het
regelmatig starten en ontladen van de loodaccu, heeft deze stroombron
doorgaans een vrij lange levensduur. Dit heeft hij te danken aan de mogelijkheid
om de elektrodematerialen te herstellen. Bij het herladen van de accu
verloopt de redox-reactie niet meer in de zelfonderhoudende, natuurlijke
richting.
Integendeel, de reactie bij het herladen van de accu :
![]()
gaat gepaard met een toename van de Gibbs-vrije energie. Deze omzetting
kan zichzelf niet onderhouden.
Ze vereist niet alleen energie bij de aanvang, maar ze moet voortdurend
van energie voorzien worden om ze blijvend in die richting te doen verlopen
(zie ook illustratie R11). Er is voortdurend elektriciteit vereist om
een accu te herladen. Zodra de stroomtoevoer wordt stopgezet, valt ook
het laadproces stil.
Om een lege accu te herladen kan men, via een 'lader' elektriciteit van het stroomnet afnemen. In het algemeen is het de rijdende wagen zelf die via een alternator/ generator de elektrische stroom creëert waarmee de accu weer op peil geraakt; d.w.z. weer voldoende Pb(s) en PbO2(s) krijgt. Tijdens een laadproces fungeert de loodaccu niet als stroombron (galvanische cel) maar als elektrolysecel (zie illustratie R11).
Noot :
ð De
elektrolysereactie is gebaseerd op de volgende
halfreacties
en hun volgorde in reducerend of
oxiderend
vermogen :
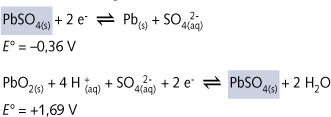
Van
de bovenstaande halfreacties reageren nu
PbSO4
en
PbSO4, nl. het bestanddeel linksboven (de
oxidator) en het bestanddeel rechtsonder (de
reductor). In feite betreft het hier een, weliswaar
opgelegde, dismutatie of autoxidoreductie-reactie
van
PbSO4, te vergelijken met de ontbindingsreactie
van
H2O2 die zelfonderhoudend verloopt (na
katalytische
aanzet weliswaar) (zie ook commentaar
bij
illustratie R10).
De
hierboven geformuleerde halfreacties komen
fundamenteel
neer op de volgende, minder
ongewone,
halfreacties :

Het verschil in voorstellingswijze en in de E°
of
E-waarden
is toe te schrijven aan de aanwezigheid
van
H2SO4 als elektrolyt, zowel in het anode- als in
het
kathodecompartiment. De ![]() ,
maar vooral de
,
maar vooral de ![]() die
door dissociatie van het tweewaardige zuur gevormd
is, dulden geen grote concentratie van
die
door dissociatie van het tweewaardige zuur gevormd
is, dulden geen grote concentratie van
Pb2+-
ionen in hun buurt : hiermee vormen ze
gemakkelijk
PbSO4, een weinig oplosbaar zout. Het
spreekt
vanzelf dat deze geringe oplosbaarheid van
PbSO4
tot gevolg heeft dat de [Pb2+]-ionen nooit de
normconcentratie
van 1 mol/L kan bereiken in een
accu.
ð In
de technisch-wetenschappelijke literatuur gebruikt
men
frequent de term 'reversibele reactie' voor de
ontlaad-
en de herlaadreactie van een loodaccu.
Voorzichtigheid
is hier geboden : deze reacties zijn
niet
omkeerbaar zoals men dit bedoelt voor
evenwichtsreacties.
Van
deze reacties kan men immers niet beweren dat
zij
in vergelijkbare omstandigheden zelfonderhoudend
kunnen
opgaan.
De
ontlaadreactie :
![]()
vergt
geen energietoevoer, zelfs niet voor het
starten.
Het
is een zelfonderhoudende, zelfs spontane
redoxreactie.
De
herlaadreactie daarentegen :
![]()
vergt
voortdurend energie. Het is een opgelegde,
nietzelfonderhoudende
en niet-spontane reactie.
Om
deze vereiste duidelijk te maken is het
aangewezen
boven de reactiepijl het symbool Q te
vermelden
dat de benodigde hoeveelheid elektriciteit
of
ladingshoeveelheid aanduidt.