CB21a: L’apparition d’orbitales hybrides de types sp et sp2
|
Obj.: • Indiquer ce que l’on entend par
hybridation. |
Dans l’ignorance de l’hybridation ou de la recombinaison d’orbitales, on escompte, pour l’hydrure de béryllium (BeH2), deux liaisons BE-H différentes: une avec l’orbitale de type 2s de Be et une autre avec l’orbitale de type 2p de Be. Toutefois, la molécule est linéaire et comprend deux liaisons équivalentes.
Il en va
de même pour le carbone qui compte deux électrons de valences qui ne vont
pas par paire et qui, par conséquent, ne pourraient former que deux liaisons.
Toutefois, le carbone peut former quatre liaisons.
Ce phénomène peut s’expliquer par l’hybridation ou la combinaison
d’orbitales atomiques. En l’occurrence, on décrit trois types:
sp, sp2 et sp3.
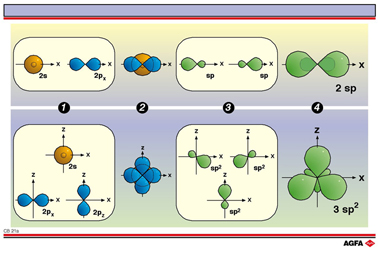
Hybridation sp:
Une orbitale de type s et une orbitale de type p (Œ) se combinent (), si bien que l'on obtient deux
orbitales identiques (Ž).
On les appelle les orbitales hybrides de type sp. Cette transition a lieu
sans modification de l'énergie. Il s'agit en l'occurrence seulement d'une
combinaison linéaire d'orbitales ou de fonctions ondulatoires.
Les deux orbitales de type sp
se trouvent sur l’axe des x et forment un angle de 180° l’une
par rapport à l’autre (structure linéaire, ). L'interaction
du lobe le plus volumineux de chaque orbitale avec une autre orbitale
donne leiu à un chevauchement efficace. Le gain d'énergie lors de la liaison
est à l'origine du phénomène d'hybridation.
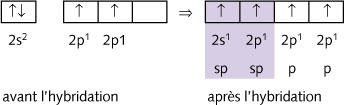
Hybridation sp: 2 orbitales hybrides de type sp par atome.
Exemple pour C:
Hybridation sp2
Lorsqu’une orbitale de type s et deux orbitales de type p (Œ) se combinent
(), on obtient trois orbitales hybrides
de type sp2
de même valeur (Ž).
Elles sont orientées dans un seul plan formant un angle de 120° (enveloppe
triangulaire, ).
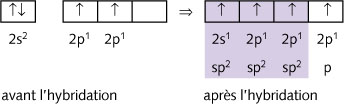
Hybridation sp2: 3 orbitales hybrides de type sp2
par atome
Exemple pour C:
Important:
Les orbitales hybrides sont des orbitales atomiques. Bien
entendu, elles peuvent se chevaucher l’une l’autre de la même
manière qu’une orbitale atomique de type s ou de type p pour former
des orbitales moléculaires. Les lobes des orbitales hybrides sont seulement
orientés d’une autre manière dans l’espace pour pouvoir obtenir
un chevauchement plus efficace.