CB21b: L’apparition d’orbitales hybrides de type sp3
|
Obj.: • Indiquer ce que l’on entend par
hybridation. |
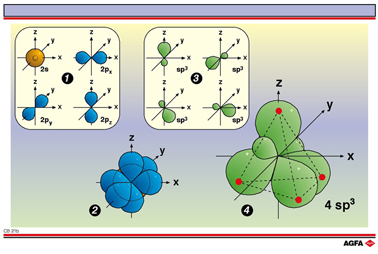
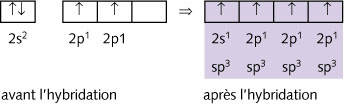
Hybridation sp3
Lorsque trois orbitales de type p et une seule orbitale de type s (Œ) se combinent
(), on obtient quatre orbitales hybrides
de type sp3
de même valeur (Ž).
Elles sont orientées de telle sorte que les lobes sont éloignés le plus
possible l’un de l’autre, c’est-à-dire orientés vers les
sommets d’un tétraèdre (enveloppe tétraédrique, ).
Hybridation sp3: 4 orbitales hybrides de type sp3 par atome
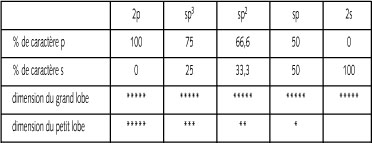
Remarque:
On représente en l'occurrence les orbitales hybrides sous la forme d'un
grand lobe et d'un petit lobe (orbitale de type p asymétrique). Il est
clair que, par la manière dont elles se combinent, l'orbitale de type
sp3 possédera plus de caractère p que l'orbitale de type sp.
Pour ces raisons, la différence de dimension des deux lobes par rapport
au grand lobe est de loin inférieure pour l'orbitale de type sp3
et pour l'orbitale de type sp2 et est par conséquent maximale
pour l'orbitale de type sp.
A des fins de clarté, on ne représente pas ces différences relatives de dimension sur l'illustration.