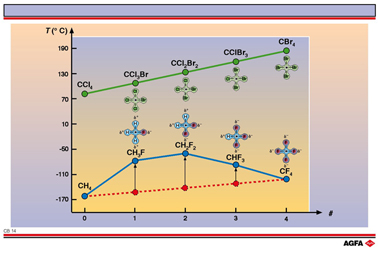
CB14: Des interactions dipolaires-dipolaires influencent les propriétés d’une substance
|
Obj.: Indiquer le fait que des interactions dipolaires-dipolaires influencent les propriétés d’une substance |
Des interactions dipolaires-dipolaires
influencent également les propriétés d’une substance. C’est
ce que l’on illustre sur l'illustration qui indique le point d’ébullition
en fonction du nombre d’atomes d’halogène substitués pour CH4
et pour CCl4.
CCl4 :
Le remplacement d’un atome de chlore par un atome de brome sur le
composé CClxBr(4-x) ne modifie pratiquement pas
le moment dipolaire de la molécule. La différence d’électronégativité
entre l’atome de chlore et l’atome de brome est minime, si bien
que la molécule reste pratiquement apolaire. Le point d’ébullition
augmente par conséquent de manière linéaire en fonction de l’augmentation
de la substitution par un atome de brome, comme on peut s’y attendre
sur base de la masse moléculaire qui augmente.
CH4
:
Le remplacement d’un atome d’hydrogène par un atome de fluor
a une influence déterminante sur le moment dipolaire. CH4 et
CF4 sont apolaires, tandis que CH3F, CH2F2
et CHF3 possèdent un grand moment dipolaire. Ceci a pour conséquence
que le point d’ébullition n’augmente pas de manière linéaire
en fonction de l’augmentation de la substitution par un atome de
fluor (ligne rouge en pointillé). Suite aux interactions dipolaires-dipolaires,
CH3F, CH2F2 et CHF3epossèdent
un point d’ébullition supérieur à celui que l’on attend sur
base de la masse moléculaire.