CB13: Les types de forces intermoléculaires
|
Obj.: Donner un aperçu des forces intermoléculaires les plus importantes |
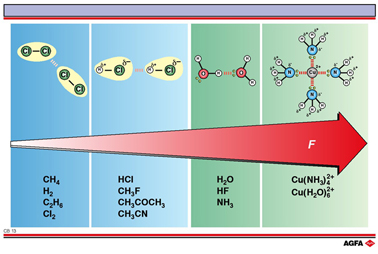
On fait une distinction entre différentes forces intermoléculaires. On peut les subdiviser en forces de dispersion ou de London, en interaction multipolaire-multipolaire (avec entre autres une interaction dipolaire-dipolaire, une interaction dipolaire-diìolaire induite, une interaction dipolaire-quadripolaire), une formation de ponts hydrogène et une interaction ionique-dipolaire. Ces sous-groupes sont représentés sur l'illustration dans l’ordre d’une énergie d’interaction croissante.
On utilise fréquemment
l’expression “forces de Vanderwaals” pour indiquer des
forces d’attraction intermoléculaires s’exerçant entre des molécules
neutres, représentées dans la partie en bleu de l'illustration: il s’agit
des forces de dispersion toujours présentes auxquelles s’ajoutent
des interactions dipolaires-dipolaires, ainsi que d’autres interactions
multipolaires selon les cas.
L’énergie d’interaction du pont hydrogène s’élève la plupart
du temps à ~ 20 kJ/mol, dont les représentants de pointes sont HF2-
(155 kJ/mol) et HCl2- , HBr2-
, HI2- (~50 kJ/mol).
Cette énergie d’interaction est significativement inférieure à celle
de la liaison chimique “forte” (ordre de grandeur de 100-500
kJ/mol), mais est supérieure à celle de l’interaction “faible”
de Vanderwaals (ordre de grandeur 0,1-5 kJ/mol). Les ponts hydrogène génèrent
de grands agrégats moléculaires dynamiques qui peuvent être rompus sans
perdre l’identité de la molécule de base (par exemple H2O).
Ils sont extrêmement importants, étant donné qu’ils déterminent nettement
les propriétés physiques et chimiques de la substance. Des interactions
ioniques-dipolaires sont comparables, en ce qui concerne leur force, à
la formation de ponts hydrogène.