CB12: Les forces intermoléculaires et intramoléculaires
|
Obj.: Illustrer les différences entre une force intermoléculaire et une force intramoléculaire à l’aide d’un exemple simple |
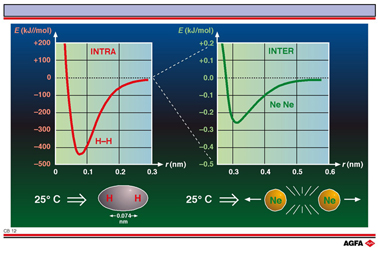
Sur cette
illustration, on représente l’énergie d’interaction en fonction
de la distance interatomique pour H - H et Ne - Ne. Les deux courbes présentent
une allure qui est constituée par une attraction à une grande distance
interatomique et par une répulsion à une petite distance interatomique,
là où les nuages électroniques des atomes se chevauchent réciproquement
(voir galement l'illustration CB01a). On remarquera néanmoins que l’échelle
d’énergie diffère fortement. Pour le système H-H, l’énergie
d’interaction maximale s’élève à
7.24 x 10-19 J à une température de 25° C (436 kJ/mol).
Etant donné que cette valeur
est significativement supérieure à l’énergie thermique disponible
(4.11 x 10-21 J à 25° C), ceci implique que les atomes d’hydrogène
se trouvent à l’état lié à la température ambiante. Les atomes d’hydrogène
sont liés de manière covalente et on parle d’une énergie de liaison.
Il s’agit d’une interaction intramoléculaire. Pour le
système
Ne - Ne, l’énergie d’interaction maximale s’élève à
~ 4 x 10-22 J à une température de 25° C (c’est-à-dire
~0.25 kJ/mole), ce qui est significativement inférieur à l’énergie
thermique disponible. L’interaction est trop faible pour former des
molécules stables dans des conditions normales, mais elle n’en est
pas moins importante pour les propriétés physiques et chimiques. On parle
d’une interaction intermoléculaire.
Remarquons la différence, non
seulement de l’échelle d’énergie, mais également de la forme
des courbes. Pour la liaison chimique covalente (telle que la liaison
H-H), on ne peut expliquer la forme de la courbe qu’à l’aide
de la mécanique ondulatoire, tandis que, pour la liaison chimique ionique
(comme par exemple la liaison
Na+-Cl-), les lois électrostatiques classiques sont
suffisantes pour expliquer l’attraction à grande distance (potentiel
d’interaction ~1/r). Pour les forces de dispersion intermoléculaires
(comme par exemple la liaison Ne - Ne), on obtient un rapport 1/r6
pour le potentiel d’interaction sur de grandes distances intermoléculaires.