CB11: La présence d’atomes, de molécules individuelles et de molécules composées dans des substances gazeuses, liquides et solides
|
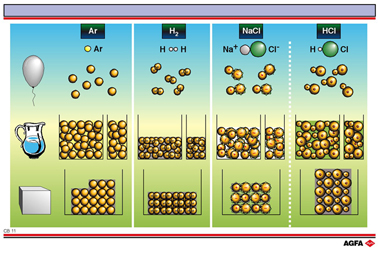
Obj.: Illustrer le fait que la délimitation d’une “molécule” est déterminée par l’état d’agrégation dans lequel une substance se trouve |
Dans des molécules individuelles (comprenant un seul type d’atomes) et dans des molécules covalentes composées (comprenant différents types d’atomes), on peut apercevoir la structure moléculaire dans les trois états d’agrégations. Aussi bien en phase solide qu’en phase liquide et qu’en phase gazeuse, on peut apercevoir les molécules individuelles. Dans la phase solide, elles sont bien emboîtées dans un réseau cristallin, mais les forces intramoléculaires (forces s’exerçant entre les atomes dans une seule molécule) sont manifestement plus intenses que les forces intermoléculaires (forces s’exerçant entre des molécules de manière réciproque).
Sur l'illustration, on présente les états d’agrégations de manière symbolique: par conséquent, par exemple du NaCl liquide et non une solution de NaCl dans de l’eau.
En ce qui concerne les ions, il en va tout autrement. Chaque ion positif attire des ions négatifs. En l’occurrence, il n’y a pas de direction préférée. Ainsi, dans un réseau cristallin, on ne peut détecter des molécules individuelles. Aussi, on ne parle pas souvent de molécules ou d’une formule moléculaire. Dans une formule brute, on représente un rapport, une formule unitaire. Tel est le cas pour la formule brute du chlorure de sodium NaCl. Dans chaque cristal, on obtient un nombre égal d’ions sodium et d’ions chlorure. La formule brute du fluorure de calcium est CaF2. On veut dire par là que, à l’état solide, dans le fluorure de calcium, on peut détecter la présence de deux fois plus d’ions fluorure que d’ions calcium. Ni dans le NaCl solide ni, dans le CaF2 solide, on ne peut néanmoins distinguer des molécules de NaCl ou de CaF2.
En revanche, en phase gazeuse, même dans le cas de liaisons ioniques, on peut parler de molécules. Chaque particule de gaz est une molécule individuelle.
Pour ces raisons, on définit le concept de molécule pour des particules en phase gazeuse comme suit: une molécule représente le groupement stable d’atomes le plus petit d’une substance en phase gazeuse.