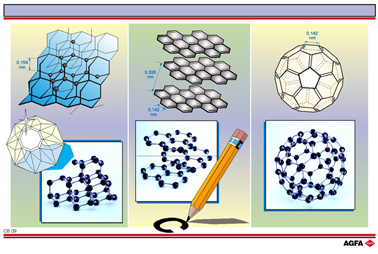
CB09: Le carbone, une substance possédant différentes formes allotropes: le diamant, le graphite, les fullerènes
|
Obj.: indiquer les trois formes allotropes différentes du carbone pour illustrer le fait que le même atome peut avoir des propriétés différentes en fonction de l’orientation et de l’hybridation |
Dans le diamant (à gauche), chaque atome de carbone est lié, via des orbitales à hybridation sp3, à quatre autres atomes de carbone dans une enveloppe tétraédrique. Tous les électrons de valence de chaque atome de carbone sont appariés dans des orbitales de liaison. Par conséquent, le diamant possède un point de fusion élevé, est stable, fait office d’isolant et représente la substance la plus dure sur terre.
Contrairement
au diamant qui est transparent avec un indice de réfraction élevé, le
graphite (au milieu) représente une matière tendre de couleur noire.
Le graphite est constitué par des couches d’anneaux plats hexagonaux
d’atomes de carbone. Les couches sont maintenues ensemble par des
forces de London relativement faibles (voir les illustrations CB13 et
CB15). Par conséquent, les couches glissent facilement l’une par-dessus
l’autre. Pour cette raison, on utilise le graphite comme lubrifiant.
Dans le graphite, chaque atome de carbone est lié, via des orbitales à
hybridation sp2, à trois autres atomes de carbone. On peut
le représenter sous la forme d’un hybride de résonance dans lequel
chaque liaison possède un caractère de double liaison partielle s’élevant
à 1 1/3.
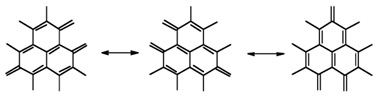
Par atome
de carbone, trois électrons de valence contribuent à la formation des
trois liaisons s. Le quatrième électron forme,
avec un de ses voisins, une liaison p. Il ne
s’agit pas d’une liaison localisée, mais d’une liaison
qui se déplace librement à travers le système p.
Parallèlement aux couches, on constate une conductivité élevée, tandis
que l’on constate une faible conductivité perpendiculairement aux
couches.
En 1985, on a découvert une
nouvelle forme allotrope, la troisième du carbone (à droite). En
fait, il s’agit de toute une série de structures dont la plus connue
est probablement le fullerène C60 de Buckminster, qui tire
son nom du célèbre architecte américain. Cette molécule est constituée
par 60 atomes de carbone répartis en 20 hexagones et en 12 pentagones
comme dans un ballon de football. Pour cette découverte, Robert F. Curl,
Sir Harold W. Kroto et Richard E. Smalley ont reçu en 1996 le prix Nobel
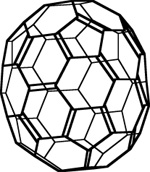
de chimie. A côté du C60, il existe encore d’autres “fullerènes”
tels que le C70, toutes sortes de structures en forme de “ballon
de rugby” ou en forme de cigare, ainsi que ce que l’on appelle
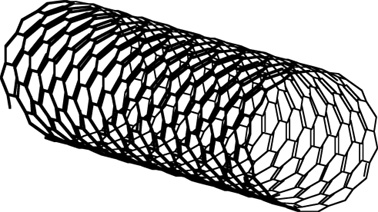
des nanotubes.
Récemment, on a également synthétisé
des composés à partir de fullerènes tels que des fullerides dans lesquels
est intercalé un métal.
Exemples d’autres types de fullerènes:
C70, un C60 légèrement étiré:
nanotube: