CB08: Des structures de réseaux
|
Obj.: Illustrer quelques structures de réseaux de liaisons ioniques et de métaux |
Des atomes, des ions et des molécules covalentes peuvent être classés à l’état solide en réseaux en trois dimensions plus ou moins ordonnés. Ces réseaux jouent un rôle dans la perspective et dans les propriétés de substances solides. On peut distinguer trois types de réseaux:
Réseaux moléculaires
Dans un réseau moléculaire, les molécules covalentes doivent encore être
considérées comme étant des entités délimitées: par exemple, dans la structure
de la glace, on peut distinguer encore des molécules de H20
individuelles.
Réseau ionique
Dans un réseau ionique, les ions de charges opposées s’attirent l’un
l’autre. Cette force d’attraction s’exerce dans toutes
les directions. Pour cette raison, on obtient un réseau en trois dimensions
dans lequel ne peuvent plus être distinguées des molécules délimitées.
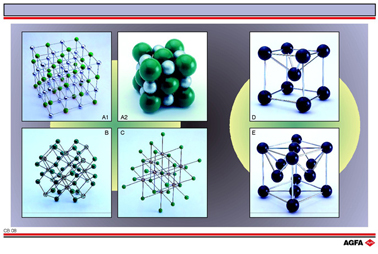
Sur l'illustration, on représente la structure des composés:
NaCl (chlorure de sodium, A1 et A2 sur l'illustration)
CaF2 (fluorure de calcium, B sur l'illustration)
CsCl (chlorure de césium, C sur l'illustration).
Dans des réseaux de ce type, on ne peut plus déterminer la capacité de
liaison normale (valence normale) des atomes sur base de leur emplacement
dans la classification périodique des éléments. Au lieu de cela, on utilise
un nouveau concept, plus précisément le nombre de coordination qui indique
le nombre d’ions limitrophes qui entourent un ion dans le réseau.
Ainsi, dans un réseau de chlorure de sodium (sel de cuisine), chaque ion sodium est entouré par 6 ions chlorure et chaque ion chlorure est entouré par 6 ions sodium.
Réseau
d’atomes métalliques
Un réseau d’atomes métalliques comprend des ions métalliques positifs
maintenus ensemble par des électrons qui se déplacent librement entre
les ions métalliques.
Sur l'illustration, on peut voir des représentations schématiques de réseaux
d’atomes métalliques du fer (en haut à droite, D) et du cuivre (en
bas à droite, E).
De même, dans des réseaux métalliques, les atomes métalliques ne s’empilent
pas de manière arbitraire mais prennent des positions bien définies dans
l’espace. Des arrangements de ce type sont représentés dans ce que
l’on appelle des cellules unitaires qui se répètent de manière continue
à travers le réseau.
Le fer métallique possède, à titre de cellule unitaire, un cube centré.
Les atomes de fer sont disposés sur les 8 sommets du cube. En outre, un
atome de fer se trouve au centre du cube. L’Atomium de Bruxelles
représente un empilement d’atomes de fer de ce type. Les atomes de
cuivre s’empilent également pour former un réseau cubique mais la
cellule unitaire est maintenant un cube à faces centrées. On veut dire
par là que les atomes de cuivre sont disposés sur les 8 sommets d’un
cube et également au centre de chaque face de ce cube.
Empilements très denses de sphères
Si l’on admet que les atomes et les ions sont de forme approximativement
sphérique et qu’ils tentent de se rapprocher le plus possible l’un
de l’autre dans un réseau, on obtient des réseaux présentant ce que
l’on appelle un empilement très dense de sphères. Les représentations
de réseaux sous la forme d’empilements très denses de sphères donnent
une image plus fidèle de la réalité, mais sont moins faciles à embrasser
d’un seul coup d’œil. Pour pouvoir observer l’arrangement
réciproque des atomes et des ions, on doit la plupart du temps démonter
le modèle de réseau étape par étape, par exemple couche par couche. Sur
l'illustration, on représente la structure du réseau de chlorure de sodium
sous la forme d’une structure ouverte (A1) et sous la forme d’une
représentation à empilement très dense de sphères (A2).