CB07: La structure de l’eau comme exemple d’une formation de ponts hydrogène
|
Obj.: Donner un exemple pratique dans lequel une formation de ponts hydrogène revêt une importance majeure |
La formation de ponts hydrogène représente, en ce qui concerne sa force, un compromis entre les liaisons chimiques “fortes” et les interactions de Vanderwaals “faibles” (voir également l'illustration CB13). Elle génère de grands agrégats moléculaires dynamiques qui peuvent être rompus sans perdre l’identité de la molécule de base.
Les ponts
hydrogène jouent un rôle essentiel dans un certain nombre de processus
biologiques, physiques et chimiques. Il est, par exemple, essentiel pour
la configuration spatiale de molécules importantes du point de vue biologique
telles que les protéines. Dans l’ADN, avec sa structure à double
hélice, des ponts se forment entre les éléments à bases puriques du premier
squelette polymère et les éléments de pyrimidine de l’autre squelette
polymère. Grâce à l’énergie d’interaction relativement faible,
les ponts hydrogène peuvent être aisément rompus entre les chaînes polymères,
si bien que l’on obtient deux chaînes polymères séparées à partir
desquelles une nouvelle double hélice peut se former. Ce procédé est crucial
pour la réplication moléculaire comme on l’indique également dans
le chapitre “Biopolymères”.
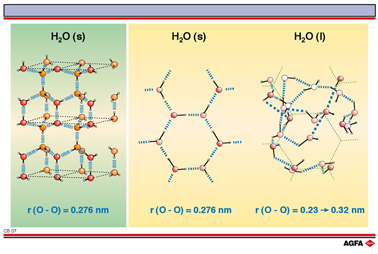
Les ponts hydrogène déterminent également, dans une large mesure, les propriétés de l’eau/de la glace. Dans la partie gauche de cette illustration, on représente la structure de la glace en trois dimensions. Le réseau possède une structure hexagonale et est constitué par des molécules d’eau qui sont liées via des ponts hydrogène. Chaque molécule d’eau possède quatre voisins dans une configuration tétragonale. De cette manière, on obtient une structure très ouverte possédant une très basse densité. Lors d’un réchauffement (jusqu’à 4° C), les ponts hydrogène sont en partie rompus, si bien que l’on obtient une structure plus dense. Lorsqu’on augmente le réchauffement, l’agitation thermique des molécules de H2O augmente et la densité du liquide diminue à nouveau. Cette allure de la densité très spécifique dépendant de la température est importante, entre autres, pour la vie sous-marine pendant la période d’hiver.
Dans la partie droite de l'illustration, on compare la structure de la glace avec un enregistrement instantané de la structure de l’eau (simulation sur ordinateur). A des fins de clarté, on indique le modèle hexagonal de la glace également avec une ligne en pointillé de couleur vert clair. On note les ponts hydrogène présents avec des lignes en pointillé de couleur bleue. Plus petite est la distance entre les points de la ligne, plus court sera le pont hydrogène. La couleur des atomes d’oxygène indique dans quelle mesure l’atome d’oxygène se trouve en dehors du plan. Les atomes blancs se trouvent dans le plan, tandis que les atomes bruns foncés se trouvent devant le plan à une distance de 0.7 à 1 nm. Les atomes rose clair et rouges se trouvent à des distances intermédiaires: plus foncée est la couleur, plus les atomes sont situés devant le plan.