CB02: Les liaisons chimiques peuvent apparaître de différentes manières
|
Obj.: Illustrer qu’il existe trois types fondamentaux importants de liaisons chimiques |
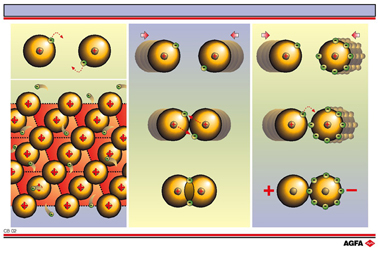
Les atomes tendent vers un état stable, vers une configuration de gaz noble. La manière dont ils le font dépend principalement du nombre d’ ”électrons de valence” (électrons se trouvant dans l’état énergétique le plus élevé à l’extérieur de l’atome) et des atomes voisins. On peut distinguer trois possibilités:
Liaison métallique
Chaque atome ne possède qu’un petit nombre d’électrons de valence.
Ces électrons de valence sont liés de manière relativement lâche. Les
atomes atteignent la configuration de gaz noble en cédant ces électrons.
On obtient alors des ions métalliques positifs (réseau métallique).
Les électrons cédés se déplacent librement à travers le réseau métallique
(électrons libres). Leur charge négative maintient ensemble les
ions métalliques positifs.
Chaque atome veut atteindre la configuration de gaz noble. Dans une liaison atomique, on atteint cette configuration par le fait que les deux noyaux mettent en commun un certain nombre d’électrons. Ce type de liaison apparaît souvent lorsque le petit nombre d’électrons de chaque atome est juste insuffisant pour atteindre la configuration de gaz noble et lorsque la différence d’électronégativité entre les deux atomes n’est pas trop élevée (voir également l'illustration CB03). Sur l'illustration CB 01b, on explique la façon permettant la mise d’électrons en commun.
Définition nominale:
Liaison atomique:
Il s’agit d’une liaison entre deux atomes neutres. Ce type de
liaison s’oppose à la liaison métallique (liaison entre des ions
et des électrons) et au type de liaison suivant: la liaison ionique (liaison
entre des ions).
Covalent:
Dérive du latin “cum valere”: posséder le même nombre, être
de même valeur.
Liaison ionique
Lorsque la différence d’électronégativité entre les deux atomes est
suffisamment grande, le premier atome est en mesure de capter des électrons
de valence de l’autre atome. Ainsi, on obtient un ion positif et
un ion négatif. Etant donné que des charges opposées s’attirent,
les deux ions sont liés l’un à l’autre.
L’atome
qui cède des électrons de valence ne possède qu’un petit nombre d’électrons
sur sa couche la plus externe et souvent huit électrons sur l’avant-dernière
couche. Lorsqu’il cède ses électrons de valence, il atteint la configuration
de gaz noble.
Il s’agit d’un arrangement très stable d’électrons autour
d’un noyau atomique qui explique la faible réactivité chimique des
gaz nobles.
Par ailleurs, il ne manque, à l’atome qui capte des électrons, que
quelques électrons pour atteindre la configuration de gaz noble.