CB01b: L’énergie de liaison
|
Obj.: Illustrer le fait que, lors de la formation d’une liaison chimique, de l’énergie se libère et que la rupture d’une liaison chimique requiert de l’énergie |
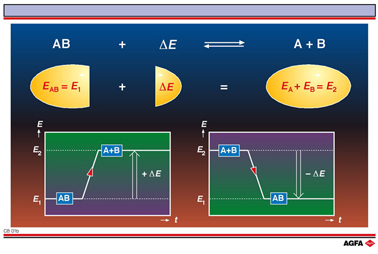
La rupture d’une liaison chimique nécessite de l’énergie.
Pour décomposer une molécule AB en particules individuelles A et B, on doit éloigner davantage les particules l’une de l’autre (voir l'illustration CB 01a). Ainsi, l’énergie potentielle des particules augmente.
Cette augmentation est représentée
sur le graphique gauche (voir l'illustration CB 01b). Sur la verticale,
on représente l’énergie (potentielle) des particules et, sur l’horizontale,
on représente le déroulement de la réaction (dans le temps). La particle
AB possède une petite quantité d’énergie (EAB =
E1). Lorsque cette particule absorbe une quantité d'énergie
(DE), la quantité d’énergie du
système augmente. Etant donné que cette énergie est suffisante pour séparer
les particules (EA + EB = E2),
on obtient l’équation:
E1 + DE = E2
Par conséquent, la rupture d’une liaison est un processus endothermique.
La modification
énergétique lors de la formation d’une liaison est représentée sur
le graphique droit.
Lorsque deux atomes forment ensemble une molécule, on obtient une particule
plus stable. En l’occurrence, de l’énergie est cédée à l’environnement:
EAB = EA + EB -
DE
La formation d’une liaison est un processus exothermique.