BP09: Le lysozyme, une enzyme spécifique
|
Obj.: Montrer la liaison entre la structure spatiale et l’activité d’une enzyme en prenant comme exemple le lysozyme |
Pour faire en sorte que des réactions chimiques dans une cellule vivante se déroulent à une vitesse acceptable, la cellule utilise toute une série de catalyseurs ou d’enzymes. Ces enzymes, la plupart du temps des protéines, accélèrent les réactions d’un facteur s’élevant jusqu’à 106 ! Au cours de la réaction, le substrat va se lier dans le site actif de l’enzyme; les inter-réactions enzyme-substrat sont très spécifiques: le substrat d’une enzyme ne va pas se lier dans le site actif d’une autre enzyme. Cette spécificité résulte des formes complémentaires du substrat et du creux ou de la fente dans lequel il se lie.
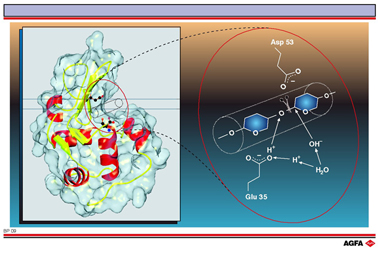
On a pu également découvrir le mécanisme catalytique via la structure cristalline. En l’occurrence, l’acide glutamique 35 et l’acide aspartique 53 jouent le rôle principal. Ces deux acides sont liés de part et d’autre de la chaîne de sucre. Le groupe acide de glu 35 cède un proton à l’atome d’oxygène du glycoside entre les unités de sucre 4 et 5 (schéma à gauche), si bien que cette liaison est rompue. L’atome de carbone 1 du noyau de sucre situé à droite est positivement chargé (carbocation) et se trouve stabilisé par la proximité du groupe carboxyle de asp 53. Le carbocation réagit avec un groupe hydroxyle provenant du solvant, si bien que glu 35 est à nouveau protoné et que la chaîne scindée quitte le centre actif.
Par diffraction des rayons X, on a pu déjà déterminer le mécanisme de fonctionnement d’un grand nombre d’enzymes.