BP10: L’a-kératine et la structure des cheveux
|
Obj.: Illustrer la structure des cheveux humains et la relation entre la composition d’un acide aminé et les propriétés d’une protéine, en se référant à l’a-kératine |
Des protéines fibreuses se distinguent
des protéines globulaires par leur forme spécifiquement étirée.
Elles jouent un rôle structurel important dans les cellules et dans les
tissus des animaux.
L’a-kératine
est la protéine la plus importante dans les cheveux et dans les ongles.
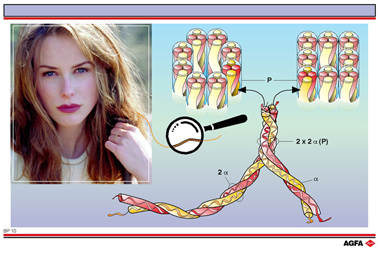
La succession des acides aminés dans l’a-kératine est à l’origine de la formation de longs domaines
d’hélices a
- dont la longueur dépasse 300 résidus. Deux hélices a (colorées en rouge et en jaune dans
la figure) s’enroulent l’une autour de l’autre en tournant
vers la gauche (2a dans la figure), et deux
hélices de ce type forment à nouveau une hélice à rotation gauche. Cette
fibre constituée par quatre molécules s’appelle une protofibrille
(P dans la figure). En définitive, huit protofibrilles, suite à un empilage
circulaire ou carré, formeront la base de la structure des cheveux à savoir
une microfibrille. Cette structure est étirable et flexible et peut être
comparée à celle d’une corde dont les différents brins sont enroulés
les uns autour des autres.
L’a-kératine
possède une teneur élevée en acide aminé sulfuré, la cystéine (à concurrence
d’environ 11%). Les groupes thiols (-SH) dans deux résidus cystéine
de ce type peuvent former par oxydation un pont disulfure
(-S-S-) et stabiliser de cette manière la structure tertiaire. Lors d’une
permanente chez le coiffeur, ces ponts disulfures seront à nouveau soumis
à une réduction. Après le réarrangement des fibres et une nouvelle oxydation,
la coiffure conservera mieux sa nouvelle forme.