T05-T06-T07: Interprétation statistique de l'entropie
But: Illustrer le rapport entre l'entropie et le désordre - interprétation statistique de l'entropie. |
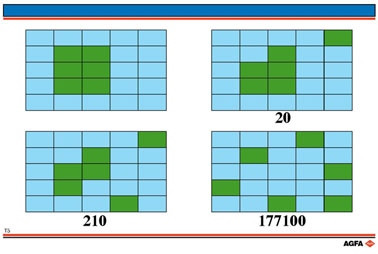
Illustration T5:
Prenez comme situation de départ un cristal de glace de 6 molécules d'eau
dans 19 molécules d'eau liquide. Lorsqu'une seule molécule passe de l'état
de glace à l'état d'eau, cette molécule d'eau peut occuper 20 positions
dans le milieu liquide. Une deuxième molécule d'eau provenant de la glace
peut occuper 21 positions possibles.
Le nombre de combinaisons différentes pour distribuer les 21 molécules
sur ces 21 positions est donc
20 x 21/2.
Puisqu'on a toujours affaire à des combinaisons doubles (p.ex. molécule 1 sur position 7 et molécule 2 sur position 10, ou vice versa), le nombre de combinaisons est divisé par 2.
Lorsqu'une
troisième molécule passe de l'état de glace à l'état d'eau, il y a 22
positions possibles dans la phase liquide et le nombre de combinaisons
sera alors égal à
20 x 21/2 x 22/3 = 1540.
Quand le cristal est entièrement fondu, 25 positions peuvent être occupées
arbitrairement et le nombre de combinaisons est égal à 177.100.
De cette interprétation statistique, il s'avère clairement que le désordre
accroît lors du passage de glace à l'eau glacée.
L'augmentation d'entropie
est calculée en divisant la quantité de chaleur ajoutée, nécessaire pour faire passer
les molécules d'eau de la phase solide (glace) à la phase liquide, par la température
absolue dans laquelle le processus a lieu (273 K ou 0 °C).
Le rapport entre entropie et désordre est donné par l'équation de Boltzmann:
S = k . ln W
où:
S = l'entropie
k = la constante de Boltzmann
W = le nombre de possibilités indistinctives pour réaliser un état donné, la
probabilité thermodynamique.
Dans l'exemple
considéré, la dissolution complète du cristal donne lieu à un nombre de
localisations différentes (W) de l'ordre de 177.100.
L'augmentation d'entropie provenant de ces possibilités de localisation
(désordre) s'appelle "l'entropie de mélange".
(T5-T6-T7 57)
Sachant que
1 mole d'eau pèse 18 g et contient
6,023 x 1023 molécules, le nombre de combinaisons est en réalité
énorme. Ceci illustre également la grande utilité de la statistique dans
la notion d'entropie.
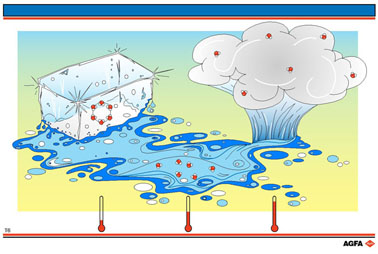
Illustration T6:
La mobilité des molécules comme degré de désordre:
le passage "glace -> eau liquide -> vapeur" correspond à un accroissement de désordre.
L'eau
peut avoir trois états d'agrégation: solide (glace), liquide (eau) et
gaz (vapeur d'eau).
La glace a une structure très ordonnée où les molécules d'eau occupent
des positions bien déterminées les unes vis-à-vis des autres et ne vibrent
que très légèrement dans leur réseau cristallin.
L'absorption
de chaleur provoque toutefois une augmentation des vibrations ce qui provoque
dans les couches extérieures du glaçon l'écartent des molécules entre
elles. La structure ordonnée disparaît et la couche fond.
Dans
l'eau en état liquide, toutes les molécules occupent une position arbitraire
puisque les distances fixes entre elles n'existent plus et elles peuvent
s'interchanger.
Le
passage d'un cristal de glace à l'état liquide, provoque l'augmentation
du désordre.
Si l'absorption de chaleur par le liquide continue, la température augmente
davantage et les molécules se déplacent tellement fortement qu'elles sortent
de la phase liquide et vont se disperser arbitrairement dans l'espace.
Elles passent alors de la phase liquide à la phase gazeuse, ce qui fait
accroître le désordre.
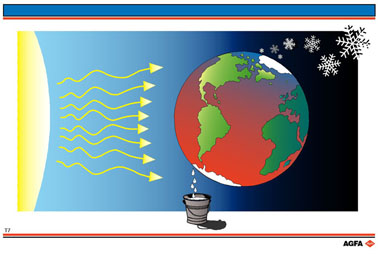
Illustration T7:
La chaleur absorbée par le système influence la transformation de glace en eau liquide.
Inversement, si le système subit une perte de chaleur, p.ex. pendant une froide nuit
d'hiver, l'eau liquide se transformera en glace. Ce phénomène s'accompagne d'une baisse
d'entropie du système considéré.
Ceci ne veut pourtant pas
dire que l'entropie diminue effectivement. Grâce au système climatologique de la terre,
qui dépend du jour, de la nuit et de la saison, l'entropie augmente à un autre endroit
sur la terre, si bien que l'entropie totale du système en entier augmente.