T05 - T06 - T07 Statistisch moleculaire interpretatie van entropie
|
Doel : Illustratie van verband tussen entropie en wanorde - statistisch moleculaire interpretatie van entropie. |
Illustratie
T5:
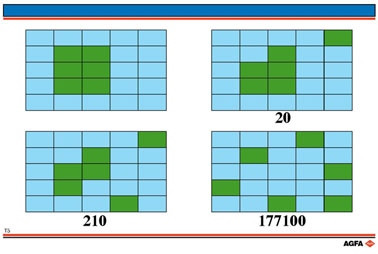
Neem als uitgangssituatie een ijskristal van 6 moleculen water in 19 moleculen
vloeibaar water.
Wanneer we vertrekken van 1 molecule die van ijs overgaat in water, dan
kan deze watermolecule 20 posities in de vloeibare omgeving innemen.
Een tweede watermolecule afkomstig uit het ijs kan 21 mogelijke posities
innemen.
Het aantal verschillende combinaties om over deze 21 plaatsen de nu 21
moleculen te verdelen, is 20 x 21/2.
Vermits er
steeds dubbele combinaties optreden (vb. molecule 1 op positie 7 en molecule
2 op positie 10, of omgekeerd) wordt het aantal combinaties gedeeld door
2. Wanneer een derde molecule ijs smelt, zijn er 22 plaatsen in de vloeibare
fase en is het aantal combinaties dan 20 x 21/2 x 22/3 = 1 540.
Wanneer het volledige kristal gesmolten is, zijn er 25 plaatsen die willekeurig
kunnen bezet worden en is het aantal combinaties = 177 100.
Uit deze statistische interpretatie blijkt duidelijk dat bij de overgang
van ijs in ijswater de wanorde toeneemt.
De entropietoename
wordt gegeven door de hoeveelheid toegevoegde warmte die nodig is om de
watermoleculen van ijs in vloeibaar te laten overgaan, gedeeld door de
absolute temperatuur waarbij dit gebeurt (273 K of 0°C).
Het verband tussen entropie en wanorde wordt weergegeven door de Boltzmann
vergelijking:
S = k . ln W
waarbij:
S = de entropie
k = constante van Boltzmann
W = het aantal ononderscheidbare realiseringsmogelijkheden van
een gegeven toestand, de thermodynamische waarschijnlijkheid.
In het beschouwde voorbeeld is bij het volledig oplossen van het kristal
het aantal plaatsingsmogelijkheden
(W) gelijk aan 177 100.
De entropietoename die uit deze keuzemogelijkheden (wanorde) voortvloeit,
noemt men mengentropie.
Wanneer we
uitgaan van het feit dat 1 mol water 18 g weegt en 6.023 x 1023 moleculen
bevat, wordt het duidelijk dat het aantal combinaties in realiteit zeer
groot wordt. Dit illustreert ook zeer duidelijk het nut van de statistiek
in het begrip entropie.
Illustratie
T6:
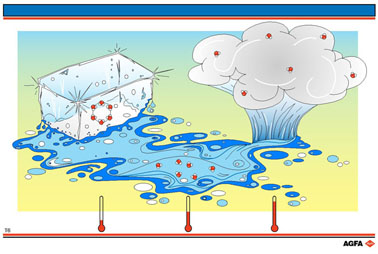
Beweeglijkheid van moleculen als maat voor wanorde : de overgang ijs ->
vloeibaar water -> damp komt overeen met een toename van wanorde.
Water komt
voor in 3 aggregatietoestanden : vast (ijs), vloeistof (water) en gas
(waterdamp).
IJs is een zeer geordende structuur, waarbij de watermoleculen welbepaalde
posities tegenover elkaar innemen en slechts lichtjes trillen in hun rooster.
Bij opname van warmte nemen de trillingen toe en in de buitenste lagen
van de ijsklomp trillen de watermoleculen van elkaar weg. De geordende
structuur verdwijnt en de laag smelt.
In het vloeibare
water kunnen alle moleculen een willekeurige plaats innemen vermits de
vaste afstanden tegenover elkaar niet meer bestaan en de moleculen van
plaats kunnen wisselen.
Bij overgang van ijskristal naar vloeistof neemt de wanorde toe.
Bij verdere warmte-opname door de vloeistof stijgt de temperatuur nog
verder en worden de bewegingen van de moleculen zo intens dat ze uit de
vloeibare fase treden en zich in de ruimte willekeurig gaan verspreiden.
De moleculen gaan hierbij van de vloeistof over in de dampfase.
Hierbij neemt de wanorde verder toe.
Illustratie T7:
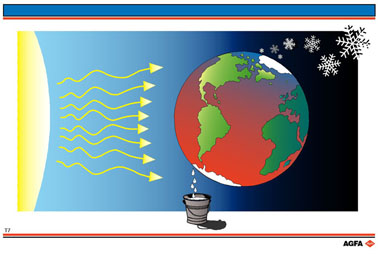
De overgang van ijs in vloeibaar water is beïnvloed door de warmte
die het systeem opneemt.
Omgekeerd, wanneer warmte aan het systeem wordt onttrokken, bv. tijdens
een koude winternacht, zal vloeibaar water in ijs overgaan. Dit proces
gaat gepaard met een verlaging van de entropie van het beschouwde systeem.
Dit wil echter niet zeggen dat de entropie daadwerkelijk afneemt vermits door de warmtehuishouding op de aarde, die afhankelijk is van dagnacht- jaargetijde, elders de entropie toeneemt, zodat tenslotte de totale entropie van het gehele systeem toeneemt.