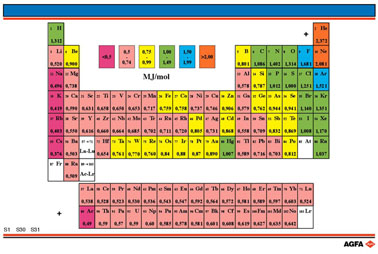
S30 - S31 De eerste ionisatie-energie
|
Doel : Een idee geven van hoe de grootte van de eerste ionisatie-energie varieert als functie van de plaats in het periodiek systeem. |
De kleurcode
maakt het mogelijk om snel te visualiseren waar de grote verschillen in
ionisatieenergie optreden.
De eerste ionisatie-energie is de energie die nodig is om 1 mol elektronen
uit de buitenste schil te verwijderen van 1 mol atomen in de grondtoestand:
A(g) -> A+(g) + e-
met A(g) een
atoom (in de gasfase) van een element.
De
waarden worden uitgedrukt in MJ/mol.
In het algemeen daalt de eerste ionisatie-energie in een groep van boven
naar onder. Ze stijgt in een periode van links naar rechts
Noteer de drie uitzonderingen:
- de edelgassen,
met ns2np6-configuratie
(behalve He) die een hoge ionisatie-energie hebben.
- de elementen
Be, Mg, Zn, Cd en Hg met een gevuld s-orbitaal in de buitenste schil.
- de elementen N, P en As met halfgevulde porbitalen in de buitenste schil.
Opmerking:
Hetzelfde zou men kunnen doen met de eerste elektronenaffiniteit. De elektronenaffiniteit
is de energieverandering geassocieerd met het proces waarin een elektron
toegevoegd wordt aan een atoom in de grondtoestand:
e- + A(g) -> A-(g)
Hier is de trend in het periodiek systeem moeilijker te herkennen (zie vorige uitzonderingen). Om die reden wordt deze dan ook achterwege gelaten.
Referenties:
1) C. E. Mortimer, Chemistry, Wadsworth Publishing Company, Belmont, California.