H03 Het zure karakter van gehydrateerde metaalionen in waterig milieu
|
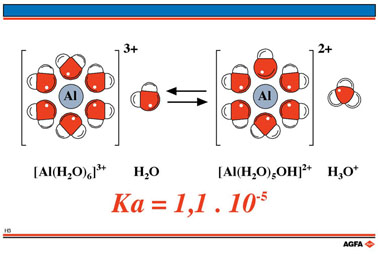
Doel : Verklaren waarom sommige gehydrateerde metaalionen zich in water kunnen gedragen als een zuur. |
Ionen worden door het oplosmiddel (water) omringd.
Bij metaalionen wordt een deel van de elektronendensiteit van de zuurstofatomen in de watermoleculen, naar het metaalion toegetrokken.
Het zuurstofatoom wil dit verlies goedmaken door de elektronendensiteit in de OH-binding op zijn beurt iets meer naar zich toe te trekken. Daardoor verzwakt de OH-binding en is het proton nu sneller in staat om zich los te maken van het watermolecule dat in de hydraatmantel is opgenomen.
De zuurconstante
van een dergelijk hydraat is bijna even groot als die van azijnzuur !