BP04 Aaneenrijgen van aminozuren via de peptidebinding
|
Doel: aantonen dat uitgaande van de aminozuurbouwstenen peptiden worden opgebouwd via de vorming van een peptidebinding. |
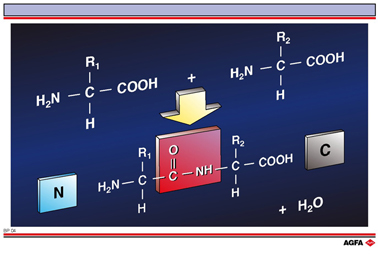
Aminozuren kunnen covalent aan elkaar gebonden worden door de vorming van een amidebinding tussen de alfa-aminogroep van het eerste aminozuur en de alfacarboxylgroep van het tweede aminozuur.
Deze binding wordt de peptidebinding genoemd en het gevormde product een dipeptide. Deze reactie is in feite een onttrekking van water aan de carboxylgroep van het ene aminozuur en aan de aminogroep van het andere. We kunnen in het voorbeeld opmerken dat het reactieproduct - het gevormde dipeptide - aan het ene uiteinde nog steeds een aminogroep (meestal N-terminus genoemd) en aan het andere uiteinde een carboxylgroep (C-terminus genoemd) bevat. Hierdoor kan de reactie in principe herhaald worden, waardoor eerst een oligopeptide ontstaat (bevat slechts enkele aminozuren) en daarna een polypeptide wanneer de keten echt langer wordt.
Bij het noteren van de primaire structuur die bij het vormen van de peptidebinding ontstaat, worden de drielettercodes van de aminozuren gebruikt. Het oligopeptide
N Gly-Leu-Ser-Asp C
verwijst
naar het aaneenschakelen van glycine, leucine, serine en asparaginezuur.
Bij conventie wordt de N-terminus steeds links en de Cterminus steeds
rechts geschreven.