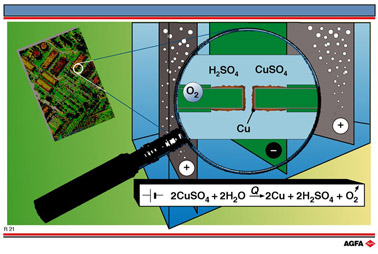
R21 Elektrochemische technieken in de elektronica
|
Doel : aantonen en illustreren dat vele oppervlaktebehandelingen van metalen en niet-metalen op elektrochemische principes berusten |
Vele moderne
voorwerpen uit het dagelijkse leven hebben oppervlaktebehandelingen ondergaan
: autoonderdelen, keukengerei, blikjes voor voedingswaren, bouwmaterialen
zoals metalen ramen of metalen dakbedekkingen enz.
Soortgelijke werkwijzen worden toegepast bij devervaardiging van elektronische
componenten zoals gedrukte schakelingen, elektrische contacten en condensatoren.
De
meeste van dergelijke bewerkingen zijn toepassingen uit de elektrochemie.
Aan de hand van de hiernavolgende voorbeelden kunnen we dit illustreren.
1. Het elektrolytisch afzetten van metalen en legeringen.
Het doel
van elektrodepositie is een oppervlaktelaag op een metaal aan te brengen
zodat de gewenste eigenschappen aan dit oppervlak verkregen worden :
hardheid, erosie- of corrosiebestendigheid, glans enz. Bovendien moet
de hechting van deze laag aan het substraat perfect zijn.
Het principe
van 'elektroplating' is vrij eenvoudig : elektrolyse. Dus redox-reacties
die niet-zelfonderhoudend zijn maar opgelegd worden door een stroombron.
De kathode is het te behandelen object. De anode wordt het best vervaardigd
uit een (elektro)chemisch inert materiaal (dure Pt- of Ti-legeringen)
of bestaat uit het metaal waarmee de kathode wordt behandeld. Het elektrolysebad
is meestal het kritische onderdeel van de cel. Het bevat het geschikte
metaalzout. Meestal is het af te zetten metaal aanwezig in een complexe
vorm.
Metaalcomplexen vertonen namelijk een grotere oplosbaarheid en stabiliteit
dan sulfaten, chlorides of andere zouten. De kunst om het geschikte bad
te bereiden zit in de toevoeging van additieven die meestal van organische
aard en slechts in geringe concentraties aanwezig zijn. Zij zijn het echter
die uiteindelijk instaan voor bepaalde belangrijke eigenschappen die de
afgezette laag eventueel moet verkrijgen :
ð Glans
: de additieven sturen de microruwheid van de
afzetting.
In de meeste gevallen is nog niet bekend
hoe
zij dit doen.
ð
Bevochtiging
: meestal treedt, tijdens het afzetten
van
het metaal, waterstofontwikkeling op. Hierdoor
kunnen
microscopische delen van het oppervlak met
dit
gas bedekt worden. Doordat de elektrolyse op
deze
plaatsen onderbroken zou worden, kan dit leiden tot
een geringere hechting. Additieven trachten dit
te
voorkomen.
ð Structuur
van de afzetting : door de inbouw van
(fragmenten
van) bepaalde organische moleculen kan de
kristalstructuur van de afzetting verstoord
worden.
Zoiets
leidt vaak tot betere eigenschappen van de
laag:
soldeerbaarheid van elektronische
componenten,
corrosieweerstand van oppervlakken,
hardheid
enz.
De dikte van elektrolytische afzettingen ligt
tussen 1 en 100 µm.
2. Het stroomloos afzetten van oppervlaktelagen
Zoals bij
elektrodepositie is het hier de bedoeling om metaalionen uit de elektrolyt
op het metaaloppervlak te reduceren, zodat de gewenste oppervlaktelaag
verkregen wordt.
Bij stroomloos afzetten wordt de drijvende kracht voor de reductie geleverd
door een tweede elektroactief bestanddeel van het bad : een reductor.
Het te behandelen metaaloppervlak moet daarom voldoende katalytische eigenschappen
hebben :
zowel de reductie van het metaal als de oxidatie van de reductor moeten
met grote snelheid op dit (katalytische) oppervlak plaats kunnen grijpen.
Om de katalytische eigenschappen van het metaaloppervlak te verzekeren, dient dit laatste vaak een activatiebehandeling, een etsstap, te ondergaan : de plaat krijgt een zo groot mogelijke specifieke oppervlakte, olieresten worden verwijderd, enz.
Reductoren
die in deze context worden gebruikt zijn H3PO3 en
formaldehyd. Aangezien het reducerend vermogen van een reductor eventueel
pH-afhankelijk is, speelt de buffering van het bad een even belangrijke
rol.
De dikte van de stroomloos afgezette metaallaagjes ligt eveneens tussen
1 en 100 µm.
3. Elektrochemische conversie van oppervlakken
Wanneer een voldoende passieve film op een metaaloppervlak ligt, kan een grote graad van corrosiebestendigheid, een betere elektrische isolatie of een fraaier uitzicht bereikt worden. Typerend voor deze techniek is dat men hierbij oxides, chromaten en fosfaten van het metaal aan het oppervlak vormt.
ð Het
anodiseren van aluminium :
Bij
het anodiseren wordt de buitenste laag van het
metaal
omgezet in zijn oxide.
Titaan,
koper, staal, tantaal en niobium worden op
deze
manier behandeld.
Het
economisch belangrijkste proces is evenwel het
anodiseren
van aluminium. Het metaal wordt hiertoe
ondergedompeld
in een oplossing van zwavelzuur,
fosforzuur
of oxaalzuur en als anode geschakeld aan
de
stroombron.
De
halfreacties die hierbij een rol spelen zijn :
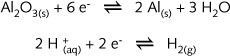
De
globale, door de elektrische stroom opgelegde
redox-reactie
wordt dan :
![]()
De
benodigde stroomintensiteit schommelt hier
tussen
1 en 100 A/m2. Naargelang van de duur van
de
anodisering kunnen laagdiktes verkregen worden
van
2 µm (bij condensatoren) tot 100 µm (bij
bouwmaterialen).
ð Het
fosfateren :
Fosfaatoppervlakken
dienen meestal als grondlaag
voor
verdere afwerking met behulp van verf of van
organische
coatings. De corrosieweerstand en
hechting
van de verflaag wordt, door de
aanwezigheid
van de grondlaag, drastisch verbeterd.
De
belangrijkste toepassingen zijn : het fosfateren
van
staal en van aluminium voor de automobiel- en
de
bouwnijverheid. De chemische en
elektrochemische
fenomenen die plaatsgrijpen tijdens de
fosfateringsstap zijn complex en nog lang niet
eenduidig
gekarakteriseerd. Deze technologie is
eerder
gebaseerd op ervaring dan op
wetenschappelijke
kennis.
ð Het
chromateren :
Ondanks
hun toxiciteit worden chromaatoplossingen
veelvuldig
gebruikt om beschermende en decoratieve
lagen
aan te brengen op voornamelijk aluminium en
zink.
De
voornaamste toepassing vindt men in de
voedingsnijverheid,
nl. aluminiumblikjes.
Vanwege
de toxiciteit van chromaten tracht men
meer
over te gaan naar chromofosfateren of
fosfateren.