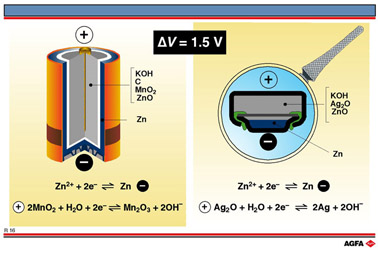
R16 Een zinkbatterij en een knopcel
|
Doel : de bouw, de samenstelling en de elektrochemische grondslagen verduidelijken voor de kleine zinkbatterij enerzijds en de knopcel anderzijds. |
Op illustratie R16 zijn twee verschillende maar vertrouwde batterijtypes weergegeven. Hun werking is gebaseerd op principes die analoog zijn aan de reacties die we voor de loodaccu beschreven (onder illustratie R15).
Voor de kleine huishoudelijke batterij zijn de toepasselijke halfreacties :
![]()
![]()
Zinkmetaal,
rechtsboven in de tabel, is de reductor of de anode. Aan deze elektrode
doet zich de oxidatie voor van Zn naar Zn2+.
In het kathodecompartiment bevindt zich vast MnO2.
Dit oxide fungeert als oxidator : het bestanddeel linksonder op een conventioneel
geschreven tabel.
Aan de kathode wordt het element Mn gereduceerd van O.T. = +IV naar O.T.
= +III.
De globale redox-reactie die plaatsvindt bij het ontladen van een Leclanché-element,
luidt:
![]()
Wanneer we de celspanning berekenen uit de normreductiepotentialen van de halfreacties, vinden we
![]()
In de praktijk bedraag de spanning voor deze batterij 1,55 V. Dit verschil is een gevolg van het feit dat de concentraties van de ionen in de cel niet gelijk zijn aan deze van normomstandigheden (zie ook vergelijking van Nernst).
De opbouw
van deze 1,5 V batterij is eerder ongewoon.
Door haar bijzonder kenmerk draagt zij nog steeds de naam van haar uitvinder,
de Franse onderzoeker Leclanché.
De kathode van een Leclanché-element is op te vatten als een volumetrische
elektrode : kleine grafietdeeltjes die in grote concentratie gedispergeerd
zijn in een pasta van KOH, MnO2 en ZnO. Grafiet doet hierin
dienst als geleider. Aan het oppervlak van deze grafietdeeltjes grijpt
de reductie van Mn (in MnO2) plaats. Dankzij hun grote concentratie
kunnen de grafietdeeltjes elkaar zó raken dat ze de elektrische
stroompjes kunnen geleiden tot aan een centrale stroomcollector die bijvoorbeeld
uit koper bestaat.
De
anode van een Leclanché-element, zink, heeft de vorm van een zinken
huls. Tijdens de ontlading van zo'n batterij zal deze zinkwand geoxideerd
worden.
Tenslotte valt nog op te merken dat de elektrodecompartimenten van elkaar
gescheiden zijn door poreus paraffinepapier en/of door was.
Knopcellen, zoals die gebruikt worden in polshorloges, fototoestellen en dergelijke, werken volgens een vrij analoog principe. De hier toegepaste halfreacties zijn :
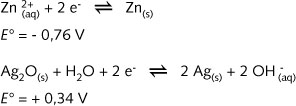
Opnieuw is Zn(s) de anode (de reductor), terwijl Ag2O(s) (de oxidator) als kathode fungeert. In het kathodecompartiment vinden we echter naast zilveroxide ook grafietdeeltjes en kwik(II)oxide terug. Als elektrolyt is opnieuw KOH gebruikt.
De globale reactievergelijking tijdens het ontlaadproces van een knopcel luidt :
![]()
Gezien hun
geringe omvang leveren beide soorten batterijen slechts een gering vermogen.
De laatste jaren is de productietechnologie van deze batterijen dermate
geoptimaliseerd dat bepaalde types van batterijen oplaadbaar zijn.