E25 Industriële toepassingen van chemische evenwichten: ontsmetten van water
|
Doel: Beschrijven, in kwalitatieve en kwantitatieve termen, hoe de basiskennis van chemische evenwichten toegepast wordt in processen waarmee wij iedere dag te maken hebben |
Drinkbaar
water is een kostbare chemische stof geworden. Voor vele mensen is zuiver
water een luxe.
Anderen verspillen er zeer veel van.
Per dag heeft een volwassen persoon ongeveer 5 liter drinkbaar water nodig.
In het Westen echter ligt het dagverbruik veel hoger :
Zo vragen :
drank- en voedselbereiding : 7 liter
schoonmaak (toilet, kleding, vaat, auto, enz) : 110 liter
doorspoelen toiletten, enz. : 80 liter
grasperk, tuin, enz. : 80 liter
Gelukkig
zien steeds meer mensen in dat drinkbaar water alleen verantwoord is voor
drank-en voedselbereiding en gebruiken zij voor de andere doeleinden veeleer
regenwater.
Toch moet steeds meer water drinkbaar of herbruikbaar gemaakt worden.
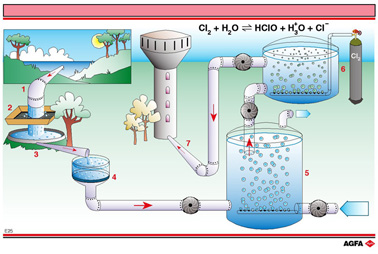
Doorgaans omvat de behandeling van water voor de openbare drinkwatervoorziening
meerdere stappen.
Op de illustratie staan de belangrijkste :
- transport vanuit een rivier
- snelle filtratie voor de verwijdering van de grotere deeltjes
- bezinking
- trage zandfiltratie
- beluchting
- ontsmetting
- transport naar watertoren
Meer
dan 90 % van bacteriën en virussen kunnen verwijderd worden tijdens
de stappen 1 tot 5.
De resterende bacteriën kunnen grotendeels onschadelijk gemaakt worden
door het toevoegen van oxiderende stoffen zoals dichloor (groene tank
op het illustratie), ozon, natriumhypochloriet, calciumhypochloriet, enz.
In leidingwater en vooral in zwembadwater kan men door de geur waarnemen
dat dichloor toegevoegd werd.
Per liter
water worden 3 tot 6 mg Cl2 onder vloeibare vorm toegevoegd.
Vloeibaar Cl2, verkregen door compresse van Cl2-gas, wordt
verkocht is stalen flessen. Het dichloor verlaat de drukfles in de vorm
van een groengeel gas dat in het water terechtkomt.
Chloorgas,een uitgesproken apolaire stof, lost normaal slechts weinig
op in water. Maar Cl2 doet meer dan oplossen, het reageert
razend snel met water.
Deze reactie, eigenlijk een auto-oxidoreductie-reactie, is in de gegeven
omstandigheden tot een evenwicht beperkt :
![]()
De ligging van het evenwicht is naar rechts verschoven.
Van het gevormde HCl staat vast dat de dissociatie volledig is. Door dichloor
in water op te lossen maakt men het water eigenlijk zuurder.
Derhalve mag je voor het zwakke hypochlorigzuur (Ka = 3,5 x 10-8)
aannemen dat de dissociatie niet ver vordert in een milieu waar de pH
bij ongeveer 7 ligt (ongeveer 2,5 %). Dat er relatief veel HClO ongedissocieerd
blijft is juist nadelig voor de bacteriën. HClO heeft immers een
veel sterkere desinfecterende werking dan het hypochloriet-anion. De nagestreefde
concentratie van HClO in zwembadwater bij een pH van 7,0 tot 7,7 bedraagt
0, 3 mg per liter water.
Doch, waterbehandeling met chloorgas garandeert niet alleen desinfectie
tot de kraan; het verhindert ook in de leidingen de groei van algen en
de vorming van slijm.