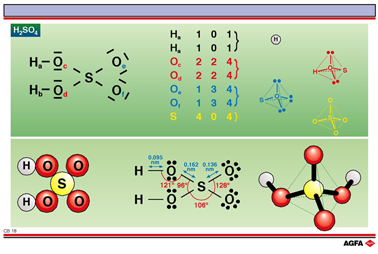
CB18: La structure de l’acide sulfurique
|
Obj.: Illustrer le fait que la structure réelle en trois dimensions d’une molécule peut légèrement dévier de la structure de base telle qu’on la déduit du nombre stérique |
Sur l'illustration, on calcule le nombre stérique à titre d’exemple pour chaque atome de la molécule de dihydrogénosulfate (acide sulfurique (H2SO4).
Ainsi, on peut constater que tous les atomes, à l’exception des deux atomes d’hydrogène, présentent un arrangement tétraédrique en ce qui concerne leurs directions de liaisons. Ainsi, on peut s’attendre au fait que les partenaires de liaison et les paires d’électrons libres encore présentes des atomes d’oxygène et de l’atome de soufre se trouvent tous dans des directions de liaisons d’environ 109°.
En réalité, il apparaît que
par exemple le “groupe d’atomes de SO4” n’est
pas un tétraèdre parfait par le fait que les atomes d’oxygène se
repoussent l’un l’autre avec la plupart des paires d’électrons
libres, si bien que leur angle de liaison avec l’atome de soufre
augmente jusqu’à environ 128°. La différence constatée des longueurs
de liaisons entre les différentes liaisons S-O va dans le sens d’un
caractère partiellement multiple des liaisons S-O sans liaison O-H.