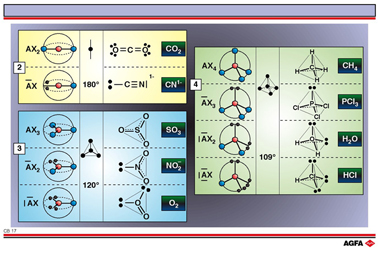
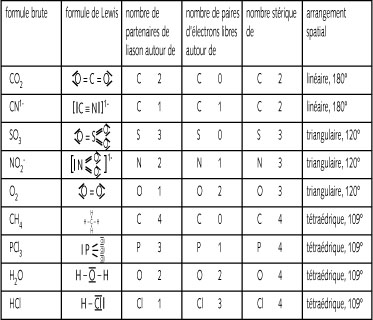
CB17: La déduction de la structure spatiale d’une molécule covalente à partir de la structure de Lewis: le nombre stérique
|
Obj.: Illustrer la façon dont on peut aisément déduire d’une formule de structure de Lewis, la structure de base en trois dimensions d’une molécule |
L’arrangement
spatial des partenaires de liaison autour d’un atome central peut
être aisément dérivé du nombre stérique (NS) qui, à son tour, peut être
déduit de la structure de Lewis.
Le nombre stérique d’un atome est égal à la somme:
- du
nombre de partenaires de liaisons
-
du nombre restant de paires d’électrons libres de cet
atome.
Le nombre
stérique varie entre les valeurs 2 à 6. Toutefois, la plupart des valeurs
sont égales à 2, 3 et 4. Le nombre stérique fournit une indication des
angles de liaisons autour d’un atome:
SG = 2 angles de liaisons: 180°
SG = 3 angles de liaisons: 120°
SG = 4 angles de liaisons: 109°
Toutefois,
le nombre stérique fournit une idée par approximation des positions spatiales
des partenaires de liaison. Les angles exacts formés entre les liaisons
dans la molécule peuvent légèrement dévier des angles de liaisons idéaux
déduits du nombre stérique. Ceci est dû à des répulsions électriques entre
des domaines riches en électrons dans une molécule ou à des empêchements
mécaniques d’atomes ou de groupes d’atomes qui, à cause de leur
grand volume, modifient la direction de liaison normale d’autres
atomes.
On détermine
le nombre stérique à partir de la structure de Lewis la plus vraisemblable.
Par conséquent, on ne prend aucunement en compte l’existence de structures
mésomères (voir également l'illustration CB05).