CB05: Les structures mésomères, les nombres d’oxydation et les charges formelles
|
Obj.: Illustrer le fait que la structure électronique des molécules ne peut pas toujours être représentée de manière correcte à l’aide d’un seul graphisme |
Une structure
de Lewis ne reflète pas la structure réelle complète d’une molécule,
elle ne fait qu’en accentuer certains aspects, comme par exemple
une distribution possible des électrons de liaison et des électrons libres
dans une molécule.
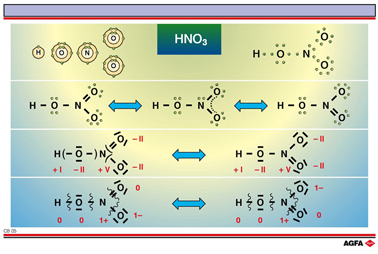
On prend pour exemple une molécule de HNO3. Les trois atomes
d’oxygène sont disposés autour de l’atome d’azote central.
L’atome d’hydrogène est lié à un des atomes d’oxygène.
Lorsqu’on se base sur la formule de Lewis, on obtient trois atomes
d’oxygène différents.
L’atome d’oxygène 1 possède deux liaisons covalentes simples
normales: une avec l’atome d’hydrogène
(DEN = 1.4) et une avec
l’atome d’azote (DEN
= 0.5).
L’atome d’oxygène 2 est lié à l’atome d’azote par
une liaison double (liaison s et liaison p,
voir les illustrations CB19 et suivants).
L’atome d’oxygène 3
atteint la configuration de gaz noble par le fait que la paire d’électrons
libres de l’azote est mise en commun par les deux atomes. Il s’agit
d’une liaison atomique polaire du type donneur-accepteur (azote:
donneur; oxygène: accepteur) par laquelle la paire d’électrons de
liaison est fournie totalement par un des partenaires de liaison, en l’occurrence
l’atome d’azote.
Une liaison multiple est toujours plus courte qu’une liaison simple.
En se basant sur des mesures des longueurs de liaison, on peut par conséquent
se faire une idée de la nature simple ou multiple de la liaison chimique.
Lorsqu’on étudie les propriétés
de la molécule de HNO3, on ne trouve néanmoins aucune différence
de longueur de liaison entre les deux liaisons N - O mentionnées en dernier
lieu. Leurs forces de liaison (énergies de liaison) semblent également
avoir la même valeur. Par conséquent, la structure réelle est une combinaison
des deux structures. Les deux liaisons représentent un compromis entre
une liaison simple et une liaison double.
Pour visualiser cette caractéristique en utilisant une formule de Lewis,
on écrit les deux structures limites. On les désigne par l’expression
structures mésomères de la molécule de HNO3.
On peut également déterminer
le nombre d’oxydation (ou le degré d’oxydation) de chaque atome
dans un composé. Le nombre d’oxydation (NO) ou degré d’oxydation
(DO) d’un atome dans un composé ou dans un ion est égal au nombre
d’électrons que l’atome repousse en tout ou en partie (nombre
d’oxydation positif) ou attire vers lui en tout ou en partie (nombre
d’oxydation négatif) lorsque l’atome est impliqué dans une liaison
chimique.
La plupart du temps, on écrit la valeur NO en chiffres romains.
La présence de ces structures mésomères n’a aucune importance pour
la valeur du nombre d’oxydation. Chaque atome d’oxygène possède
une valeur NO -II dans la molécule HNO3; l’atome d’azote
a la valeur NO +V et l’atome d’hydrogène a la valeur +I.
La somme des nombres d’oxydation dans un composé neutre est toujours
égale à zéro.
Lorsque des liaisons covalentes
du type donneur-accepteur apparaissent dans une molécule, on peut attribuer
aux atomes concernés une charge formelle. L’atome d’azote
met en commun deux électrons avec l’atome d’oxygène. Dans une
liaison covalente normale, chaque atome met un électron en commun pour
former la paire d’électrons de liaison. C’est comme si l’atome
d’azote cédait un électron à l’atome d’oxygène pour ainsi
former une paire d’électrons de liaison. Du point de vue formel,
l’atome d’azote cède par conséquent un électron: charge formelle
+1 et, de ce point de vue, l’atome d’oxygène capte un électron:
charge formelle -1.
Dans les deux structures mésomères, la charge formelle des deux atomes
d’oxygène est différente.
L’indication des nombres d’oxydation ou des charges formelles
dans des structures de Lewis et dans les structures mésomères qui en dérivent
est importante dans certains domaines de la chimie.
Les nombres d’oxydation jouent un rôle important dans les réactions
d’oxydation-réduction (voir à cet égard également le chapitre Electrochimie
dans DIDAC-3). Des charges formelles sont importantes pour l’étude
des mécanismes de réaction en chimie organique.