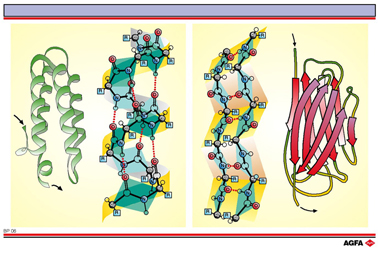
BP06: L’hélice a et le feuillet b
|
Obj.: Caractériser les deux structures secondaires les plus importantes |
Les deux structures secondaires les plus importantes ont déjà été présentées en 1951 par Linus Pauling et Robert Corey: l’hélice a et le feuillet b.
Dans l’hélice a (à gauche), la chaîne polypeptidique est enroulée sous forme hélicoïdale avec 3,6 résidus par spire. L’hélice tourne vers la droite et est stabilisée par une formation de ponts hydrogène intramoléculaires (dans la chaîne) entre un groupe C=O et le groupe N-H qui est situé quatre résidus plus loin. L’hélice a est présentée généralement de manière schématique par un ruban en spirale qui indique uniquement la position de la chaîne peptidique.
La nature des chaînes latérales
R qui sont orientées vers l’extérieur déterminera le nombre de domaines
à hélice a qui apparaît dans la structure secondaire. C’est ainsi que,
par exemple, un résidu de proline ne pourra pas participer à la structure
de l’hélice a ou que la succession
de différents résidus d’isoleucine déstabilisera la formation d’une
hélice a à cause de l’empêchement
stérique entre les grands groupes latéraux R.
Dans le
feuillet b (à droite), chaque résidu a effectué
une rotation de 180° par rapport au précédent; un certain nombre de chaînes
voisines (dans la figure, on n’en représente que deux) se plient
en accordéon, la formation de ponts hydrogène intermoléculaires (entre
les chaînes) maintenant le tout ensemble. On représente le feuillet b de manière schématique par une flèche; une fois de plus, on ne
représente pas en réalité les chaînes latérales. L’orientation de
la flèche correspond à l’orientation N ![]() C de la chaîne polypeptidique. Lorsque des chaînes voisines s’étendent
dans la même direction, on parle d’un feuillet b parallèle. On parle d’un
feuillet b
antiparallèle lorsque les chaînes voisines s’étendent dans des directions
opposées (comme indiqué sur l'illustration).
C de la chaîne polypeptidique. Lorsque des chaînes voisines s’étendent
dans la même direction, on parle d’un feuillet b parallèle. On parle d’un
feuillet b
antiparallèle lorsque les chaînes voisines s’étendent dans des directions
opposées (comme indiqué sur l'illustration).