BP01: Les acides aminés: les constituants des protéines
|
Obj.: Représenter la structure de base de quelques acides aminés spécifiques |
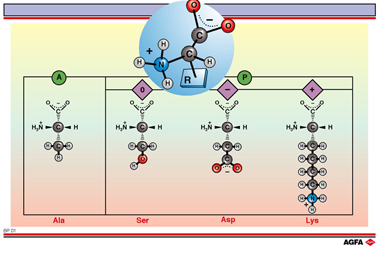
Les acides aminés alpha représentent des constituants ou des monomères pour les protéines et ils sont constitués par:
- un groupe carboxyle;
- et, implantés sur l’atome de carbone juste à coté de ce groupe carboxyle (atome de carbone alpha): un groupe amino, un atome d’hydrogène et une chaîne latérale R.
Les différents acides aminés se distinguent par leurs différentes chaînes latérales et sont généralement représentés par un code de trois lettres (par exemple ala pour alanine).
Dans des conditions de pH neutre, le groupe carboxyle aura cédé un proton tandis que le groupe amino en aura fixé un. C’est ainsi que l’on obtient la structure zwittérionique.
Les vingt acides aminés différents se distinguent nettement l’un de l’autre par la grande variété des groupes chimiques dans les chaînes latérales:
![]() Groupes apolaires
R
Groupes apolaires
R
Huit acides aminés possèdent une chaîne latérale apolaire et présentent
un caractère hydrophobe. Quatre (l’alanine, la valine, la leucine
et l’isoleucine) possèdent un groupe R aliphatique acyclique tandis
que, dans la proline, la chaîne latérale est à nouveau liée à l’atome
d’azote du groupe amino (acide aminé cyclique). La méthionine comprend
un atome de soufre dans la chaîne latérale apolaire tandis que la phénylalanine
et le tryptophane possèdent un noyau aromatique insoluble dans l’eau.
![]() Groupes
polaires R non chargés
Groupes
polaires R non chargés
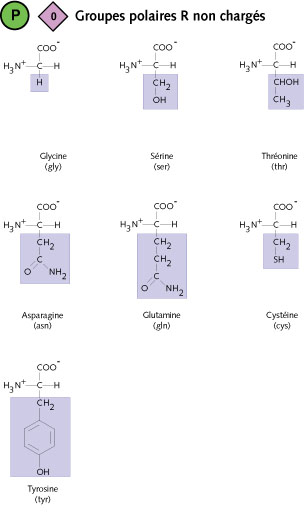
Cette classe comprend sept acides aminés qui sont relativement hydrophiles
grâce à la présence des groupes fonctionnels polaires dans les chaînes
latérales. La sérine, la thréonine et la tyrosine comprennent un groupe
hydroxyle (OH) tandis que la cystéine – l’autre acide aminé
contenant un atome de soufre – comprend un groupe thiol (SH). L’asparagine
et la glutamine dérivent de l’acide aspartique et de l’acide
glutamique (classe suivante) et possèdent chacun un groupe amide polaire
dans leur chaîne latérale. Enfin, on considère que l’acide aminé
le plus simple, la glycine, qui possède un atome d’hydrogène sous
forme de chaîne latérale, appartient également à cette classe, étant donné
que le petit groupe latéral n’a aucun effet sur le caractère hydrophile
de l’acide aminé.
![]() Groupes
polaires R chargés négativement
Groupes
polaires R chargés négativement
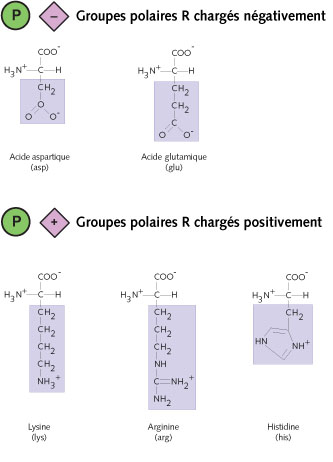
Aussi bien l’acide aspartique que l’acide glutamique comprennent
un deuxième groupe carboxyle qui, dans des conditions de pH physiologique
(niveau d’acidité de la plupart des liquides corporels dont le pH
fluctue entre 6,5 et 8,0), est chargé négativement.
![]() Groupes
polaires R chargés positivement
Groupes
polaires R chargés positivement
La lysine et l’arginine, deux des trois acides aminés basiques, comprennent
une chaîne latérale contenant un atome d’azote, qui, dans des conditions
de pH physiologique, est chargée positivement. Le troisième acide aminé
dans cette série, l’histidine, comprend un noyau pentagonal contenant
un atome d’azote (groupe imidazole) et présente une protonation à
concurrence de seulement 10% à un pH de 7.
A côté des vingt acides aminés courants que l’on retrouve toujours dans les protéines et dans leur codage par l’ADN, il existe encore plusieurs acides aminés modifiés et plusieurs acides aminés importants du point de vue biologique qui néanmoins n’apparaissent pas dans les protéines.
L'illustration ne donne qu’un seul exemple par classe. Le tableau annexé fournit les formules développées de l’ensemble des vingt acides aminés répartis conformément aux mêmes classes.