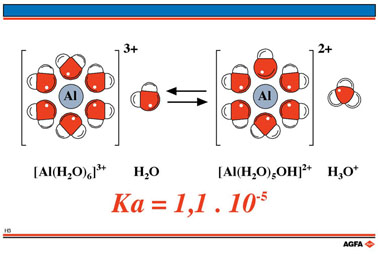
But: Montrer
pourquoi certains sels métalliques hydratés peuvent se comporter dans l'eau comme des
acides. |
|
|
Les ions sont entourés par les molécules de
solvant (eau). La densité électronique des atomes d'oxygène des molécules d'eau est
partiellement attirée vers les ions métalliques. L'atome d'oxygène compense cette
"perte" en attirant une partie de la densité électronique de la liaison O-H.
Celle-ci est ainsi affaiblie et le proton se libère plus facilement de la molécule d'eau
pour former un proton hydraté. La constante d'acidité d'un tel hydrate est
presque aussi élevée que celle de l'acide acétique ! |
