C02 Les forces d'interaction dans un système colloïdal
But: Montrer les forces d'interaction actives dans un système colloïdal. |
Du fait que les particules
dans un système colloïdal ont des dimensions réduites, elles sont en perpétuel
mouvement. Elles s'approchent et se heurtent sans cesse. Leur surface spécifique élevée
fait que le nombre de collisions sont très fréquentes et que les particules possèdent
une haute réactivité.
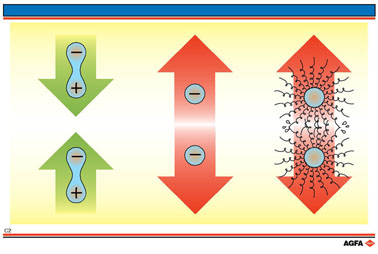
- la force d'attraction de Van der Waals causée par la présence de dipôles (induits ou non) dans les particules.
- les forces de répulsion de Coulomb du fait que les particules portent une charge du même signe, p.ex. par l'adsorption d'ions de la phase continue. Les charges de même signe se repoussent mutuellement.
- la répulsion stérique se manifeste lorsque de grosses molécules (polymères, électriquement chargées ou non) sont adsorbées à la surface des particules. "L'enveloppe velue" se formant ainsi, empêche que les particules s'approchent à une distance suffisamment courte permettant la force d'attraction de Van der Waals de les "unir".
La stabilité d'un système
colloïdal dépend de l'équilibre entre ces trois forces. Lorsque les forces d'attraction
l'emportent sur celles de répulsion, les particules "s'agglutinent" lors d'une
collision. Lorsque les forces de répulsion l'emportent, la collision entraîne un
"effet de billard" (pensez aux balles dans le tambour du loto ou aux boules dans
un jeu de snooker).