C01 Les systèmes colloïdaux: suspensions, émulsions, aérosols, dispersions
But: Montrer les caractéristiques principales d'un système colloïdal. |
Le monde des colloïdes se situe entre celui de la solution moléculaire et celui des systèmes macroscopiquement observables. Les particules dans un système colloïdal ont normalement des dimensions entre 1 et 1000 nanomètres, déterminant ainsi un certain nombre de caractéristiques importantes des systèmes colloïdaux:
- Leurs dimensions
inférieures font qu'elles soient soumises au mouvement de Brown, faisant en sorte que les
particules se déplacent dans tous les sens et se heurtent.
- Par leurs dimensions inférieures, elles vont également agir sur la lumière d'une façon singulière. Le fait que les nuages soient blancs et que la fumée d'une cigarette soit bleuâtre avant de l'inhaler et blanche au moment de l'exhaler, s'explique par la diffusion de lumière causée par les particules colloïdales.
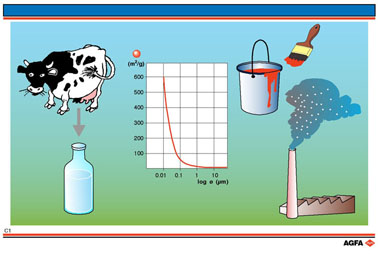
Le monde autour de nous montre un tas d'exemples de systèmes colloïdaux. Leur classification est basée sur l'état d'agrégation de leur phase disperse et de leur phase continue dans laquelle ils se trouvent:
- Suspension: un solide dans un liquide.
p.ex. peinture, boue
- Emulsion: un liquide dans un liquide.
p.ex. lait, mayonnaise
-
Aérosol: un liquide ou un solide dans un gaz.
p.ex.
fumée, spray
- Dispersion: dénomination commune pour suspension,
émulsion
et aérosol.
![]()