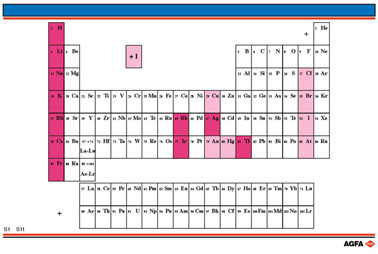
S11 De oxidatiegetallen
|
Doel : Weergeven van de voornaamste oxidatiegetallen van de elementen wanneer ze in verbindingen voorkomen. |
De 12 overleg-illustraties (S11-S22) zijn allen volgens hetzelfde patroon opgebouwd.
Afhankelijk van het teken van het oxidatiegetal, wordt een rode (positief) of blauwe (negatief) kleur gebruikt. Daar een aantal elementen meerdere oxidatiegetallen kunnen hebben, werd bijkomend geopteerd om de belangrijkste in een donkerdere kleur te benadrukken (in de zwart-wit originelen werden die elementen met een cirkel gemarkeerd).
Dit heeft als gevolg dat bijvoorbeeld de groepen Ia en IIa als duidelijke +I en +II zuilen geprojecteerd worden, maar omwille van de volledigheid en wetenschappelijke correctheid, worden bij het oxidatiegetal +I ook de halogenen( in een welliswaar lichtere kleur) getoond.
Voor de lanthaniden en actiniden worden geen oxidatiegetallen gegeven en, om didactische redenen, worden ook geen oxidatiegetallen gegeven voor de edelgassen (niettegenstaande Kr, Xe en Rn toch ook verbindingen kunnen aangaan).
Voor bepaalde metalen
(V, Cr, Mn, Fe, Co, Ni, Mo, Ru, Rh, Pd, W, Os, Ir en Pt) kan het oxidatiegetal
de waarde nul hebben. Deze gevallen worden niet vermeld.
Volledigheidshalve wordt opgemerkt dat vier metalen het oxidatiegetal
-II kunnen hebben (Mn, Co, Re, en Ir) en Fe, Ru en Os zelfs het oxidatiegetal
-II.
Ook dit wordt niet in de illustratie vermeld.
Referentie
:
De volledige informatie is terug te vinden in het periodiek systeem
van de elementen, uitgebracht door het JVCV in april 1989, als bijlage
bij Elektron (volume 3, nummer 3).