ST07
Scheiden van vloeibaar-vloeibaarmengsels (oplossingen)
|
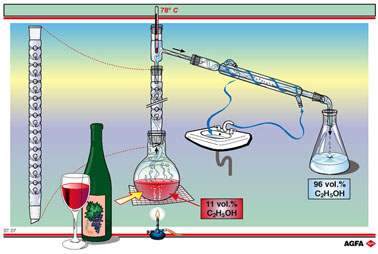
Doel : tonen van gefractioneerde destillatie voor de scheiding van
vloeibaar-vloeibaarmengsels waarbij de kookpunten van de componenten
weinig verschillen. |
Om een volledige scheiding door destillatie te verkrijgen, mag de damp die eerst condenseert alleen deeltjes (moleculen) bevatten van de component met het laagste kookpunt (de vluchtigste component van het mengsel). Dit kan alleen zeer dicht benaderd worden wanneer de kookpunten van de te scheiden componenten voldoende ver uit elkaar liggen. Als vuistregel kan gesteld worden dat bij een gewone destillatie dit kookpuntsverschil minimaal 25 °C moet bedragen. Zelfs in deze gevallen bevat het destillaat ook deeltjes (moleculen) van de minder vluchtige componenten van het mengsel en is de scheiding nooit volledig.
In de praktijk
wordt gebruikgemaakt van gefractioneerde destillatie, een techniek met
een hoger scheidend vermogen.
Hiermee is het mogelijk om scheidingen te verkrijgen van vloeistofmengsels
waarbij het verschil in kookpunt van de samenstellende componenten merkelijk
kleiner is dan 25 °C. Een perfecte scheiding van het mengsel is ook
met deze techniek niet mogelijk.
Deze efficiëntere scheiding wordt verkregen door tussen de destilleerkolf
en de koeler (Liebig-koeler) een fractioneerkolom, de zogenaamde Vigreux-kolom,
te plaatsen. Dergelijke
kolom is een buis gevuld met glazen bolletjes of staafjes of is een buis
waarvan de wanden voorzien zijn van vele instulpingen (zie illustratie).
De opstijgende damp wordt bij deze techniek bijgevolg verplicht door deze
kolom te gaan. Door de lagere temperatuur hoger in de fractioneerkolom
condenseert het dampmengsel. De opstijgende damp moet, om de condensator
te bereiken, door neerdruppelend condensaat gaan. Door innig contact van
de deeltjes (moleculen) van de opstijgende damp met neervallend condensaat,
kunnen enkel de deeltjes (moleculen) van de stof met het laagste kookpunt
hogerop komen.
Bijgevolg, hoe hoger in de kolom, des te rijker de damp aan deeltjes (moleculen)
van de vluchtigste component is.
Theoretische achtergrond :
Indien de samenstellende vluchtige componenten de wet van Raoult
volgen, dan geldt voor de totale dampspanning boven het mengsel Ptot
= X1P01 + X2P02.
De bijdrage van iedere component is recht evenredig met de molfractie
X van deze component vermenigvuldigd met zijn dampspanning in zuivere
toestand P0. Dit is een geval van een ideaal mengsel dat door
destillatie zeer goed kan gescheiden worden.
De scheiding zal des te vollediger zijn naarmate de kookpunten verder
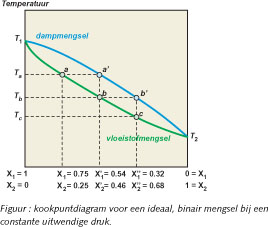
uit elkaar liggen. Onderstaande figuur geeft het samenstellingsverloop
van een mengsel van twee componenten dat de wet van Raoult volgt. In de
ordinaat orden de kookpunten aangegeven van de zuivere componenten van
het mengsel (T1 en T2). Beide punten zijn verbonden
door twee krommen die het verloop geven van respectievelijk de samenstelling
van het vloeistof- (onderste kromme) en het dampmengsel (bovenste kromme).
De abcis geeft de samenstelling van het mengsel weer.
Een mengsel met molfractie van component 1 gelijk aan 0.75 (X1
= 0.75) en van component 2 gelijk aan
0.25 (X2 = 0.25) zal koken bij een temperatuur Ta. De onderste
kromme geeft de samenstelling weer van de vloeistoffase.
Voor dit mengsel is dit het punt a op deze kromme. De dampfase hiermee
in evenwicht heeft als samenstelling a’, waarvan de molfracties
voor beide componenten respectievelijk X1’ = 0.54 en
X2’ = 0.46 bedragen. Hieruit volgt dat de damp rijker
wordt aan de vluchtigste component 2.
Wordt de
damp met deze samenstelling gecondenseerd, dan is het aldus verkregen
mengsel aangerijkt aan de vluchtigste component. Dit stelt een stap in
het destillatieproces voor. De dampfase die in evenwicht is met de vloeistofsamenstelling
b, heeft de samenstelling b’ met als molfracties X1’’
= 0.32 en
X2’’ = 0.68. Bij afkoeling wordt een vloeistof
verkregen met deze samenstelling c. Dit is de tweede destillatiestap.
Bij elke destillatiestap neemt bijgevolg de molfractie van de vluchtigste
component (component 2) steeds verder toe.
Bij de gefractioneerde destillatie is het aantal doorlopen destillatiestappen
veel groter dan bij een gewone destillatie.
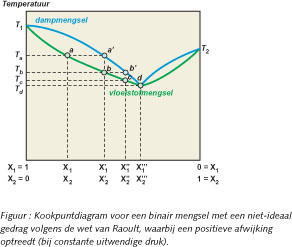
Wordt Raoult’s wet niet gevolgd, dan treden er afwijkingen op. Deze
afwijkingen worden veroorzaakt door verschillen in interacties tussen
de moleculen in het mengsel. Men spreekt van positieve afwijkingen indien
de totale dampspanning bij een bepaalde samenstelling van het mengsel
hoger ligt dan de partiële druk van de zuivere componenten.
In dit geval is de aantrekkingskracht tussen de moleculen van beide componenten
kleiner dan de aantrekking tussen identieke moleculen binnen iedere component
afzonderlijk.
Dit resulteert in een mengsel met een lager kookpunt dan dat van de zuivere
componenten. Bij negatieve afwijkingen is het andersom.
Onderstaande
figuur geeft een kookpuntsdiagram voor een tweecomponentenmengsel met
een positieve afwijking.
Een voorbeeld is de destillatie van het mengsel water/ethanol. In dit
geval wordt van een azeotrope destillatie gesproken, waarbij een azeotroop
mengsel verkregen wordt. Zoals hierboven gesteld, treedt in het kookpuntdiagram
een punt op dat een lager kookpunt Td (78.2 ° C) heeft
dan de kookpunten van resp. water T1 (100 °C) en ethanol
T2 (78.3 °C) en waarvoor de samenstelling in de vloeistoffase
gelijk is aan de samenstelling van de gasfase.
Dit betekent dat het mengsel zich in dit punt als een zuivere stof gedraagt.
Immers, daar de samenstelling van de dampfase gelijk is aan de samenstelling
van de vloeistoffase, kan dit mengsel niet verder gescheiden worden. De
samenstelling van het water/ethanol mengsel bedraagt in dit punt d respectievelijk
4 vol.% water (X1’’’ = 0.04). en 96 vol.%
ethanol
(X2’’’ = 0.96). In het voorbeeld van het
tranparant ST07 wordt van wijn vertrokken. Wijn heeft een ethanolgehalte
van iets meer dan tien percent. Door gefractioneerde destillatie wordt
een mengsel verkregen dat 96 vol.% ethanol en 4 vol.% water bevat. Voor
het verkrijgen van 100 vol.% ethanol moet het bovenvermelde mengsel verder
behandeld worden met een
droogmiddel, bv. CaCl2.