BP04: La formation de chaînes d’acides aminés via la liaison peptidique
|
Obj.: Montrer que l’on obtient des peptides à partir des constituants des acides aminés par la formation d’une liaison peptidique |
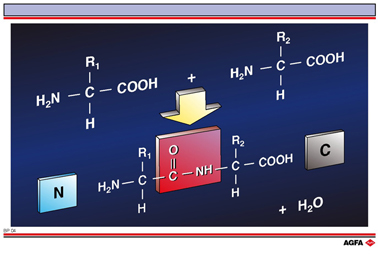
Les acides aminés peuvent être liés l’un à l’autre de manière covalente par la formation d’une liaison amide entre le groupe amino alpha du premier acide aminé et le groupe carboxyle alpha du deuxième acide aminé.
Cette liaison est désignée par l’expression liaison peptidique et le produit formé est un dipeptide. Cette réaction est en fait une élimination d’eau sur le groupe carboxyle du premier acide aminé et sur le groupe amino de l’autre. On peut faire remarquer dans cet exemple que le produit réactionnel - le dipeptide qui s’est formé – possède, à une extrémité, toujours un groupe amino (la plupart du temps désignée par l’expression “extrémité N-terminale”) et, à l’autre extrémité, un groupe carboxyle (désigné par l’expression “extrémité C-terminale”). Ainsi, la réaction peut se répéter en principe, si bien que l’on obtient d’abord un oligopeptide (qui ne comprend que quelques acides aminés) et ensuite un polypeptide lorsque la chaîne devient vraiment plus longue.
Lorsqu’on représente la structure primaire que l’on obtient lors de la formation de la liaison peptidique, on utilise les codes en trois lettres des acides aminés. L’oligopeptide
N Gly-Leu-Ser-Asp C
indique
l’enchaînement de la glycine, de la leucine de la sérine et de l’acide
aspartique. Par convention, on écrit toujours l’extrémité N-terminale
à gauche et l’extrémité C-terminale à droite.