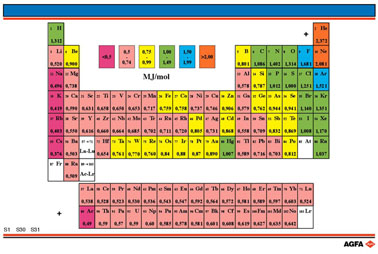
S30 - S31 La première énergie d'ionisation
But: Montrer comment l'ampleur de la première énergie d'ionisation varie en fonction de sa position dans le système périodique. |
Le code couleurs permet de
visualiser rapidement où se manifestent les grandes différences en énergie
d'ionisation.
La première énergie d'ionisation est celle nécessaire pour arracher 1
mole d'électrons de la couche la plus extérieure de 1 mole d'atomes dans
l'état fondamental:
A(g) -> A+(g)+ e-
où A(g) est
un atome (en phase gazeuse) d'un élément.
En général, la première
énergie d'ionisation diminue dans un groupe de haut en bas. Elle augmente
dans une période de gauche à droite.
Notez les trois exceptions:
- les gaz rares, avec une structure ns2np6 (à l'exception de He), qui ont une énergie d'ionisation élevée.
- les éléments Be, Mg, Zn, Cd et Hg avec une orbitale s remplie dans la couche la plus extérieure.
- les éléments N, P et As qui ont des orbitales p remplies à moitié dans la couche la plus extérieure.
Remarque:
On pourrait faire le même pour la première affinité électronique. L'affinité
électronique est le changement d'énergie associé au processus dans lequel un électron
est ajouté à un atome dans l'état fondamental.
e- + A(g) -> A-(g)
Dans ce cas-ci pourtant, la tendance dans le système périodique est plus difficile à percevoir (voir les exceptions précédentes). Pour cette raison elle a été omise.
Référence:
1) C.E. Mortimer, Chemistry, Wadsworth Publishing Company, Belmont, California.